
London erzwingt Eigenschaften und Beispiele
Das Londoner Streitkräfte, Londoner Streukräfte oder induzierte Dipol-Dipol-Wechselwirkungen sind die schwächste Art intermolekularer Wechselwirkungen. Sein Name ist auf die Beiträge des Physikers Fritz London und seine Studien auf dem Gebiet der Quantenphysik zurückzuführen.
Londons Kräfte erklären, wie Moleküle interagieren, deren Strukturen und Atome es ihm unmöglich machen, einen permanenten Dipol zu bilden. das heißt, es gilt grundsätzlich für unpolare Moleküle oder isolierte Atome von Edelgasen. Im Gegensatz zu den anderen Van-der-Waals-Kräften erfordert diese extrem kurze Strecken.

Eine gute physikalische Analogie der Londoner Streitkräfte findet sich im Betrieb des Klettverschlusssystems (Bild oben). Durch Drücken einer Seite des mit Haken bestickten Stoffes und der anderen Seite mit Fasern wird eine Anziehungskraft erzeugt, die proportional zur Fläche des Stoffes ist.
Sobald beide Gesichter versiegelt sind, muss eine Kraft ausgeübt werden, um ihren Wechselwirkungen (die von unseren Fingern ausgeführt werden) entgegenzuwirken und sie zu trennen. Gleiches gilt für Moleküle: Je sperriger oder flacher sie sind, desto größer sind ihre intermolekularen Wechselwirkungen auf sehr kurzen Entfernungen..
Es ist jedoch nicht immer möglich, sich diesen Molekülen in einer Entfernung zu nähern, die nahe genug ist, damit ihre Wechselwirkungen spürbar sind..
In diesem Fall erfordern sie sehr niedrige Temperaturen oder sehr hohe Drücke. als solches ist der Fall von Gasen. Ebenso können diese Arten von Wechselwirkungen in flüssigen Substanzen (wie n-Hexan) und festen Substanzen (wie Jod) vorhanden sein..
Artikelverzeichnis
- 1 Funktionen
- 1.1 Homogene Lastverteilung
- 1.2 Polarisierbarkeit
- 1.3 Sie ist umgekehrt proportional zur Entfernung
- 1.4 Es ist direkt proportional zur Molekülmasse
- 2 Beispiele für Londoner Streitkräfte
- 2.1 In der Natur
- 2.2 Alkane
- 2.3 Halogene und Gase
- 3 Referenzen
Eigenschaften
Welche Eigenschaften muss ein Molekül haben, damit es mit Londoner Kräften interagieren kann? Die Antwort ist, dass jeder es tun könnte, aber wenn es ein permanentes Dipolmoment gibt, überwiegen Dipol-Dipol-Wechselwirkungen mehr als streuende und tragen sehr wenig zur physikalischen Natur von Substanzen bei..
In Strukturen, in denen es keine hochelektronegativen Atome gibt oder deren elektrostatische Ladungsverteilung homogen ist, gibt es kein Extrem oder keine Region, die als reich (δ-) oder arm (δ +) an Elektronen angesehen werden kann.
In diesen Fällen müssen andere Arten von Kräften eingreifen, sonst könnten diese Verbindungen nur in der Gasphase existieren, unabhängig von den Druck- oder Temperaturbedingungen, die auf sie einwirken..
Homogene Lastverteilung
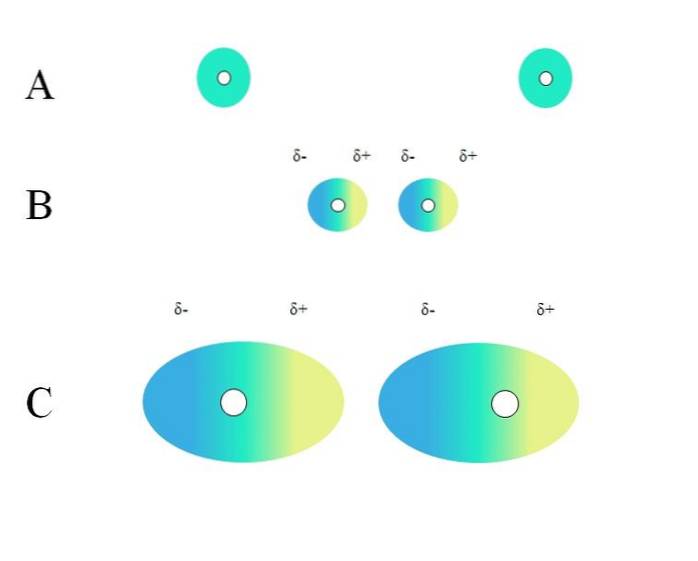
Zwei isolierte Atome wie Neon oder Argon weisen eine homogene Ladungsverteilung auf. Dies ist in A oben zu sehen. Die weißen Kreise in der Mitte repräsentieren die Kerne für Atome oder das Molekülgerüst für Moleküle. Diese Ladungsverteilung kann als grüne Elektronenwolke betrachtet werden.
Warum erfüllen Edelgase diese Homogenität? Da ihre elektronische Hülle vollständig gefüllt ist, sollten ihre Elektronen theoretisch die anziehende Ladung des Kerns in allen Orbitalen gleichermaßen spüren..
Andererseits ist bei anderen Gasen wie atomarem Sauerstoff (O) seine Hülle unvollständig (was in seiner elektronischen Konfiguration beobachtet wird) und zwingt sie, das zweiatomige Molekül O zu bildenzwei um diesen Mangel auszugleichen.
Die grünen Kreise in A können auch kleine oder große Moleküle sein. Seine Elektronenwolke umkreist alle Atome, aus denen es besteht, insbesondere die elektronegativsten. Um diese Atome herum ist die Wolke konzentriert und negativer, während andere Atome einen elektronischen Mangel aufweisen.
Diese Wolke ist jedoch nicht statisch, sondern dynamisch, so dass sich irgendwann kurze δ- und δ + -Regionen bilden und ein Phänomen genannt wird Polarisation.
Polarisierbarkeit
In A zeigt die grüne Wolke eine homogene Verteilung der negativen Ladung an. Die vom Kern ausgeübte positive Anziehungskraft kann jedoch auf die Elektronen schwingen. Dies bewirkt eine Verformung der Wolke, wodurch Bereiche δ- in Blau und δ + in Gelb erzeugt werden..
Dieses plötzliche Dipolmoment im Atom oder Molekül kann eine benachbarte Elektronenwolke verzerren. Mit anderen Worten, es induziert einen plötzlichen Dipol am Nachbarn (B, oberes Bild)..
Dies liegt daran, dass die δ-Region die benachbarte Wolke stört, ihre Elektronen eine elektrostatische Abstoßung spüren und am entgegengesetzten Pol orientiert sind und δ erscheinen+.
Beachten Sie, wie die positiven Pole mit den negativen Polen ausgerichtet sind, genau wie Moleküle mit permanenten Dipolmomenten. Je voluminöser die Elektronenwolke ist, desto schwieriger wird es, wenn der Kern sie im Raum homogen hält. und auch, je größer die Verformung davon ist, wie in C zu sehen ist.
Daher ist es weniger wahrscheinlich, dass Atome und kleine Moleküle von Partikeln in ihrer Umgebung polarisiert werden. Ein Beispiel für diese Situation ist das kleine Wasserstoffmolekül H.zwei.
Damit es kondensiert oder noch mehr kristallisiert, benötigt es exorbitanten Druck, um seine Moleküle zur physikalischen Wechselwirkung zu zwingen.
Sie ist umgekehrt proportional zur Entfernung
Obwohl augenblickliche Dipole gebildet werden, die andere um sie herum induzieren, reichen sie nicht aus, um die Atome oder Moleküle zusammenzuhalten..
In B gibt es eine Entfernung d das trennt die beiden Wolken und ihre beiden Kerne. Damit beide Dipole für eine überlegte Zeit in dieser Entfernung bleiben können d es muss sehr klein sein.
Diese Bedingung, ein wesentliches Merkmal der Londoner Streitkräfte (denken Sie an den Klettverschluss), muss erfüllt sein, damit sie sich spürbar auf die physikalischen Eigenschaften der Materie auswirkt..
Einmal d klein ist, beginnt der Kern links in B, die blaue δ-Region des benachbarten Atoms oder Moleküls anzuziehen. Dadurch wird die Wolke weiter deformiert, wie in C zu sehen ist (der Kern befindet sich nicht mehr in der Mitte, sondern rechts). Dann kommt ein Punkt, an dem sich beide Wolken berühren und "abprallen", aber langsam genug, um sie für eine Weile zusammenzuhalten..
Daher sind die Londoner Streitkräfte umgekehrt proportional zur Entfernung d. In der Tat ist der Faktor gleich d7, Eine geringfügige Änderung des Abstands zwischen den beiden Atomen oder Molekülen schwächt oder verstärkt die Londoner Streuung.
Es ist direkt proportional zur Molekülmasse
Wie kann man die Wolken vergrößern, damit sie leichter polarisieren? Hinzufügen von Elektronen, und dafür muss der Kern mehr Protonen und Neutronen haben, wodurch die Atommasse erhöht wird; oder Hinzufügen von Atomen zum Rückgrat des Moleküls, was wiederum seine Molekülmasse erhöhen würde
Auf diese Weise ist es weniger wahrscheinlich, dass die Kerne oder das Molekülgerüst die Elektronenwolke die ganze Zeit gleichmäßig halten. Je größer die in A, B und C betrachteten grünen Kreise sind, desto polarisierbarer sind sie und desto größer sind auch ihre Wechselwirkungen durch Londoner Streitkräfte..
Dieser Effekt ist zwischen B und C deutlich zu beobachten und könnte noch größer sein, wenn die Kreise einen größeren Durchmesser hätten. Diese Argumentation ist der Schlüssel zur Erklärung der physikalischen Eigenschaften vieler Verbindungen anhand ihrer Molekularmassen..
Beispiele für Londoner Streitkräfte

In der Natur
Im Alltag gibt es unzählige Beispiele für Londons Zerstreuungskräfte, ohne sich überhaupt in die mikroskopische Welt zu wagen..
Eines der häufigsten und überraschendsten Beispiele findet sich in den Beinen von Reptilien, die als Geckos bekannt sind (oberes Bild), und in vielen Insekten (auch in Spiderman)..
An ihren Beinen haben sie Polster, aus denen Tausende kleiner Filamente herausragen. Auf dem Bild sehen Sie einen Gecko, der am Hang eines Felsens posiert. Um dies zu erreichen, nutzt es die intermolekularen Kräfte zwischen dem Gestein und den Filamenten seiner Beine..
Jedes dieser Filamente interagiert schwach mit der Oberfläche, auf die das kleine Reptil klettert. Da es jedoch Tausende von ihnen gibt, üben sie eine Kraft aus, die proportional zur Fläche ihrer Beine ist und stark genug ist, damit sie haften bleiben und klettern können. Geckos sind auch in der Lage, glatte und perfekte Oberflächen wie Glas zu besteigen..
Alkane
Alkane sind gesättigte Kohlenwasserstoffe, die auch von Londoner Streitkräften interagieren. Ihre molekularen Strukturen bestehen einfach aus Kohlenstoffen und Wasserstoffatomen, die durch Einfachbindungen verbunden sind. Da der Unterschied in der Elektronegativität zwischen C und H sehr gering ist, handelt es sich um unpolare Verbindungen.
Somit ist Methan, CH4, Der kleinste Kohlenwasserstoff von allen kocht bei -161,7 ° C. Wenn C und H zum Gerüst hinzugefügt werden, werden andere Alkane mit höheren Molekularmassen erhalten.
Auf diese Weise entstehen Ethan (-88,6ºC), Butan (-0,5ºC) und Oktan (125,7ºC). Beachten Sie, wie sich ihre Siedepunkte erhöhen, wenn die Alkane schwerer werden.
Dies liegt daran, dass ihre elektronischen Wolken polarisierbarer sind und ihre Strukturen eine größere Oberfläche haben, was den Kontakt zwischen ihren Molekülen erhöht..
Obwohl Octan eine unpolare Verbindung ist, hat es einen höheren Siedepunkt als Wasser.
Halogene und Gase
Londoner Streitkräfte sind auch in vielen gasförmigen Substanzen vorhanden. Zum Beispiel Moleküle von N.zwei, H.zwei, COzwei, F.zwei, Clzwei und alle Edelgase interagieren durch diese Kräfte, da sie eine homogene elektrostatische Verteilung aufweisen, die augenblickliche Dipole erleiden und zu Polarisationen führen kann.
Die Edelgase sind He (Helium), Ne (Neon), Ar (Argon), Kr (Krypton), Xe (Xenon) und Rn (Radon). Von links nach rechts steigen ihre Siedepunkte mit zunehmender Atommasse: -269, -246, -186, -152, -108 und -62 ºC.
Durch diese Kräfte interagieren auch Halogene. Fluor ist bei Raumtemperatur ein Gas wie Chlor. Brom mit einer höheren Atommasse wird unter normalen Bedingungen als rötliche Flüssigkeit gefunden, und Jod bildet schließlich einen violetten Feststoff, der schnell sublimiert, weil er schwerer als andere Halogene ist.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 452-455.
- Angeles Mendez. (22. Mai 2012). Dispersionskräfte (aus London). Wiederhergestellt von: quimica.laguia2000.com
- Londoner Dispersionskräfte. Wiederhergestellt von: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22. Juni 2018). 3 Arten von intermolekularen Kräften. Wiederhergestellt von :oughtco.com
- Ryan Ilagan & Gary L. Bertrand. Londoner Dispersionswechselwirkungen. Entnommen aus: chem.libretexts.org
- ChemPages Netorials. Londoner Streitkräfte. Wiederhergestellt von: chem.wisc.edu
- Kamereon. (22. Mai 2013). Geckos: Der Gecko und die Kräfte von Van der Waals. Wiederhergestellt von: almabiologica.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.