
Struktur, Eigenschaften, Herstellung, Verwendung von Aluminiumphosphat (AlPO4)

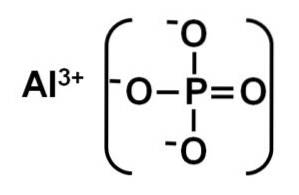
Das Aluminiumphosphat ist ein anorganischer Feststoff, der durch ein Aluminiumion Al gebildet wird3+ und ein Phosphation PO43-. Seine chemische Formel lautet AlPO4. Es ist ein weißer Feststoff, dessen Kristallstruktur der von Siliciumdioxid-SiO ähnlich istzwei. Es ist wasserunlöslich.
Es kann aus Aluminiumoxid (AlzweiODER3) und Phosphorsäure (H.3PO4). Es kann auch ausgehend von wässrigen Lösungen von Aluminiumchlorid (AlCl) erhalten werden3) und Natriumphosphat (Na3PO4).

Aluminiumphosphat hat einen sehr hohen Schmelzpunkt, weshalb es häufig als Bestandteil feuerfester Keramiken verwendet wird, dh Keramiken, die sehr hohen Temperaturen standhalten..
Es wird auch als Antazida für den Magen, in Mischungen zur Reparatur von Zähnen und als Adjuvans für Impfstoffe verwendet, dh um die Immunantwort des Körpers zu stimulieren.
Einige feuerfeste Betone haben AlPO4 in seiner Zusammensetzung, die die mechanischen und Hochtemperatur-Trageeigenschaften dieser Art von Zement erhöht.
Es wurde als Schutzschild verwendet, um das Verbrennen brennbarer Materialien wie bestimmter Polymere zu verhindern.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3.6 Andere Eigenschaften
- 4 Erhalten
- 5 Verwendung in Keramik
- 5.1 Herstellung von Aluminiumphosphatkeramiken
- 6 Andere Verwendungen
- 6.1 Bei der Gewinnung von Beton
- 6.2 In Zahnzementen
- 6.3 In Impfstoffen
- 6.4 Als Flammschutzmittel in Polymeren
- 7 Referenzen
Struktur
Die AlPO4 Es wird durch ein Aluminiumkation Al gebildet3+ und ein Phosphatanion PO43-.
Kristallines Aluminiumphosphat wird auch als Berlinit- oder Alpha-Phase (α-AlPO) bezeichnet4) und seine Kristalle sind quarzähnlich.

Die Alpha-Phase von Aluminiumphosphat ist ein Feststoff, der durch ein kovalentes Netzwerk von PO-Tetraedern gebildet wird4 und AlPO4 diese wechseln sich ab und sind durch Sauerstoffatome verbunden.
Diese Struktur ist mit Siliciumdioxid isomorph, dh sie hat die gleiche Form wie die von Siliciumdioxid-SiOzwei.
Nomenklatur
- Aluminiumphosphat
- Aluminiummonophosphat
- Aluminiumsalz der Phosphorsäure.
Eigenschaften
Körperlicher Status
Festes weißes kristallines.
Molekulargewicht
121,93 g / mol
Schmelzpunkt
1800 ºC
Dichte
2,56 g / cm3
Löslichkeit
Nicht in Wasser löslich
Andere Eigenschaften
Die Struktur des AlPO4 ist Silica SiO sehr ähnlichzwei, es teilt also viele physikalische und chemische Eigenschaften davon.
Aluminiumphosphat ist ein hochfestes Material, das heißt, es widersteht sehr hohen Temperaturen, ohne seinen physikalischen Zustand oder seine Struktur zu verändern und ohne sich zu zersetzen.
Die AlPO4 kristallin oder berlinit wandelt sich beim Erhitzen in eine Struktur vom Tridymit-Typ und dann in einen Cristobalit-Typ um, andere Formen dieser Verbindung, die Siliciumdioxid-SiO ähnelnzwei.

Erhalten
Aluminiumphosphat AlPO4 kann durch die Reaktion zwischen Phosphorsäure H erhalten werden3PO4 und Aluminiumoxid AlzweiODER3. Eine Temperaturanwendung ist erforderlich, beispielsweise zwischen 100 und 150 ° C..
ZumzweiODER3 + 2 h3PO4 = 2 AlPO4 + 3 H.zweiODER
Es kann auch durch Verbinden einer wässrigen Lösung von Aluminiumchlorid AlCl erhalten werden3 mit einer wässrigen Lösung von Natriumphosphat Na3PO4::
AlCl3 + N / A3PO4 = AlPO4 + 3 NaCl
Verwendung in Keramik
Aluminiumphosphat AlPO4 wird oft in der Konstitution von Aluminiumoxidkeramik gefunden.
Keramik mit hohem Aluminiumoxidgehalt ist eines der Materialien, die aufgrund ihrer Härte in Anwendungen eingesetzt werden, in denen sie hohen Belastungen und schwierigen Bedingungen standhalten muss..
Diese Art von Keramik ist beständig gegen Korrosion, Hochtemperaturumgebungen, heißes Dampf oder reduzierende Atmosphären wie Kohlenmonoxid (CO)..
Aluminiumoxidkeramik hat auch eine geringe elektrische und thermische Leitfähigkeit, weshalb sie zur Herstellung von feuerfesten Ziegeln und elektrisch isolierenden Bauteilen verwendet wird..

Denn Aluminiumphosphat bildet sich bei einer viel niedrigeren Temperatur als Silica SiOzwei, Die Herstellung ist billiger, was einen Vorteil bei der Herstellung von Keramiken darstellt, die für anspruchsvolle Dienstleistungen geeignet sind.
Herstellung von Aluminiumphosphatkeramik
Aluminiumoxid wird verwendetzweiODER3 und Phosphorsäure H.3PO4 in wässrigem Medium.
Der bevorzugte Formations-pH beträgt 2-8, da es eine Fülle von gelösten Phosphorsäurespezies wie H gibtzweiPO4- und HPO4zwei-. Bei saurem pH die Konzentration an Al-Ionen3+ ist hoch und kommt aus der Auflösung von Aluminiumoxid AlzweiODER3.
Zunächst wird ein hydratisiertes Aluminiumdiphosphat-Trihydrogen-Gel AlH gebildet.3(PO4)zwei.H.zweiODER:
Zum3+ + H.zweiPO4- + HPO4zwei- + H.zweiO ⇔ AlH3(PO4)3.H.zweiODER
Es kommt jedoch eine Zeit, in der der pH-Wert der Lösung abfällt und neutral wird, wo das Aluminiumoxid AlzweiODER3 es hat eine geringe Löslichkeit. Zu diesem Zeitpunkt bildet das unlösliche Aluminiumoxid eine Schicht auf der Oberfläche der Partikel, wodurch verhindert wird, dass die Reaktion fortgesetzt wird..
Daher ist es notwendig, die Löslichkeit des Aluminiumoxids zu erhöhen, und dies wird durch leichtes Erhitzen erreicht. Beim Erhitzen auf 150 ° C setzt das Gel die Reaktion mit Aluminiumoxid Al fortzweiODER3 Freisetzung von Wasser und kristallinem Berlinit (alpha-AlPO)4).
ZumzweiODER3 + 2 AlH3(PO4)3.H.zweiO → AlPO4 + 4 hzweiODER
Der Berlinit bindet die einzelnen Partikel und bildet die Keramik.
Andere Verwendungen
Die AlPO4 Es wird als Antazida, als Adsorbens, als Molekularsieb, als Katalysatorträger und als Beschichtung zur Verbesserung der Beständigkeit gegen Heißkorrosion verwendet. Unter anderen Anwendungen.
Bei der Beschaffung von Beton
Aluminiumphosphat ist Bestandteil von feuerfesten oder hitzebeständigen Betonen.
Es bietet diesen Betonen hervorragende mechanische und brechende Eigenschaften, wie z. B. Wärmebeständigkeit. Im Temperaturbereich zwischen 1400 und 1600 ° C ist Zellbeton auf Aluminiumphosphatbasis eines der effizientesten Materialien als Wärmeisolator..
Es muss nicht getrocknet werden, seine Aushärtung wird durch eine sich selbst ausbreitende exotherme Reaktion erreicht. Es ist möglich, Ziegel aus diesem Material jeder Form und Größe herzustellen.
In Zahnzementen
Aluminiumphosphat ist Teil von Zahnzementen oder Materialien, die zur Heilung verfaulter Zähne verwendet werden.
In Zahnzementen wird Aluminiumoxid als Moderator von Säure-Base-Reaktionen verwendet, wobei der Moderationseffekt auf die Bildung von Aluminiumphosphat auf den Partikeln anderer Materialien zurückzuführen ist..
Diese Zemente weisen eine sehr hohe Druck- und Zugfestigkeit auf, was auf das Vorhandensein von Aluminiumphosphat zurückzuführen ist.
In Impfstoffen
Die AlPO4 Es wird seit vielen Jahren in verschiedenen Impfstoffen für Menschen eingesetzt, um die Immunantwort des Körpers zu stärken. Es wird gesagt, dass die AlPO4 Es ist ein "Adjuvans" für Impfstoffe. Der Mechanismus ist noch nicht gut verstanden.
Es ist bekannt, dass die immunstimulierende Wirkung von AlPO4 es hängt vom Prozess der Adsorption des Antigens an das Adjuvans ab, dh von der Art und Weise, wie es daran haftet. Ein Antigen ist eine Verbindung, die beim Eintritt in den Körper die Bildung von Antikörpern zur Bekämpfung einer bestimmten Krankheit erzeugt.
Antigene können an AlPO adsorbiert werden4 durch elektrostatische Wechselwirkungen oder durch Bindung an Liganden. Sie werden an der Oberfläche des Adjuvans adsorbiert.
Es wird ferner angenommen, dass die Partikelgröße von AlPO4 es hat auch Einfluss. Je kleiner die Partikelgröße ist, desto größer und länger hält die Antikörperantwort an..
Als Flammschutzmittel in Polymeren
Die AlPO4 Es wurde als Flammschutzmittel und zur Verhinderung der Verbrennung oder Verbrennung bestimmter Polymere verwendet.
Die Zugabe von AlPO4 zu einem Polypropylenpolymer, das bereits ein Flammschutzmittel aufweist, bewirkt einen synergistischen Effekt zwischen beiden Verzögerern, was bedeutet, dass der Effekt viel größer ist als der beider Feuerhemmer getrennt.
Wenn das Polymer einer Verbrennung ausgesetzt oder in Gegenwart von AlPO verbrannt wird4, Es entsteht ein Aluminiummetaphosphat, das die verkohlte Oberfläche durchdringt und deren Poren und Risse ausfüllt.
Dies führt zur Bildung eines hocheffizienten Schutzschildes, um ein Verbrennen oder eine Verbrennung des Polymers zu verhindern. Mit anderen Worten die AlPO4 Versiegelt die verkohlte Oberfläche und verhindert das Verbrennen des Polymers.

Verweise
- Abyzov, V.A. (2016). Leichter feuerfester Beton auf Basis von Aluminium-Magnesium-Phosphat-Bindemittel. Procedia Engineering 150 (2016) 1440-1445. Von sciencedirect.com wiederhergestellt.
- Wagh, A.S. (2016). Aluminiumphosphatkeramik. In chemisch gebundener Phosphatkeramik (2. Auflage). Kapitel 11. Von sciencedirect.com wiederhergestellt.
- Mei, C. et al. (2019). Adjuvans für Aluminiumphosphat-Impfstoffe: Analyse von Zusammensetzung und Größe mit Offline- und Inline-Werkzeugen. Comput Struct Biotechnol J. 2019; 17: 1184–1194. Von ncbi.nlm.nih.gov wiederhergestellt.
- Qin, Z. et al. (2019). Synergistischer Barriereeffekt von Aluminiumphosphat auf flammhemmendes Polypropylen auf Basis des Ammoniumpolyphosphat / Dipentaerythrit-Systems. Materials and Design 181 (2019) 107913. Von sciencedirect.com wiederhergestellt.
- Vrieling, H. et al. (2019). Stabilisierte Aluminiumphosphat-Nanopartikel, die als Impfstoff-Adjuvans verwendet werden. Kolloide und Oberflächen B: Biointerfaces 181 (2019) 648-656. Von sciencedirect.com wiederhergestellt.
- Schaefer, C. (2007). Magen-Darm-Medikamente. Antazida. In Drogen während der Schwangerschaft und Stillzeit (2. Auflage). Von sciencedirect.com wiederhergestellt.
- .

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.