
Lithiumfluoridstruktur, Eigenschaften, Gewinnung, Verwendung

Das Lithiumfluorid Es ist ein anorganischer Feststoff, dessen chemische Formel LiF ist. Es besteht aus Li-Ionen+ und F.- die über eine Ionenbindung verbunden sind. Es kommt in geringen Mengen in verschiedenen Mineralien vor, insbesondere in Silikaten wie Lepidolit, in Meerwasser und in vielen Mineralbrunnen.
Es ist aufgrund seiner Transparenz in einem weiten Bereich von Wellenlängen, vom Infrarot (IR) -Spektrum bis zum ultravioletten UV, durch das Sichtbare, in optischen Geräten weit verbreitet.

Es wurde auch in Geräten verwendet, um gefährliche Strahlung an Arbeitsplätzen zu erkennen, an denen Menschen für kurze Zeit ihnen ausgesetzt sind. Darüber hinaus wird es als Material zum Schmelzen von Aluminium oder zur Herstellung von Gläsern für Linsen oder Gläser sowie zur Herstellung von Keramik verwendet..
Dient als Beschichtungsmaterial für Lithium-Ionen-Batteriekomponenten und verhindert den anfänglichen Ladungsverlust der Batterien.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Brechungsindex
- 3.7 Löslichkeit
- 3.8 Andere Eigenschaften
- 4 Sammlung und Ort
- 5 Verwendungen
- 5.1 In optischen Anwendungen
- 5.2 In ionisierenden oder gefährlichen Strahlungsdetektoren
- 5.3 Als Material zum Vorliterieren der Kathode von Lithiumbatterien
- 5.4 In verschiedenen Anwendungen
- 6 Referenzen
Struktur
Lithiumfluorid ist eine ionische Verbindung, die durch Vereinigung des Li-Kations gebildet wird+ und das Anion F.-. Die Kraft, die sie zusammenhält, ist elektrostatisch und wird als Ionenbindung bezeichnet..
Wenn sich Lithium verbindet, gibt es ein Elektron an Fluor ab, wobei beide in einer stabileren Form als die ursprüngliche Form verbleiben, wie nachstehend erläutert wird.
Das Element Lithium hat die folgende elektronische Konfiguration: [He] 1szwei 2s1 und beim Übertragen eines Elektrons sieht die elektronische Struktur folgendermaßen aus: [He] 1szwei das ist viel stabiler.
Das Element Fluor, dessen elektronische Konfiguration lautet: [Ne] 1szwei 2szwei 2 P.5, Wenn es das Elektron annimmt, bleibt es in der Form [Ne] 1szwei 2szwei 2 P.6, stabiler.
Nomenklatur
- Lithiumfluorid
- Fluorolithium
- Lithiummonofluorid
Eigenschaften
Körperlicher Status
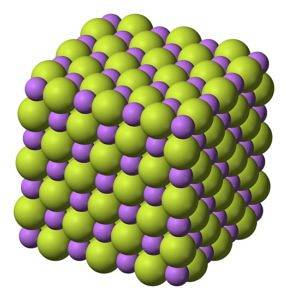
Weißer Feststoff, der in kubischer Struktur kristallisiert, wie Natriumchlorid NaCl.
Molekulargewicht
26 g / mol
Schmelzpunkt
848,2 ºC
Siedepunkt
1673 ºC, obwohl es sich bei 1100-1200 ºC verflüchtigt
Dichte
2,640 g / cm3
Brechungsindex
1,3915
Löslichkeit
In Wasser schwer löslich: 0,27 g / 100 g Wasser bei 18 ºC; 0,134 g / 100 g bei 25 ° C. Löslich in saurem Medium. In Alkohol unlöslich.
Andere Eigenschaften
Seine Dämpfe weisen dimere Spezies (LiF) aufzwei und trimer (LiF)3. Mit Flusssäure bildet HF Lithiumbifluorid LiHFzwei;; bildet mit Lithiumhydroxid ein Doppelsalz LiF. LiOH.
Sammlung und Ort
Lithiumfluorid LiF kann durch die Reaktion zwischen Flusssäure HF und Lithiumhydroxid LiOH oder Lithiumcarbonat Li erhalten werdenzweiCO3.
Es ist jedoch in geringen Mengen in bestimmten Mineralien wie Lepidolith und im Meerwasser enthalten..

Anwendungen
In optischen Anwendungen
LiF wird in Form von kompakten Kristallen in Infrarot (IR) -Spektrophotometern verwendet, da sie im Wellenlängenbereich zwischen 4000 und 1600 cm eine hervorragende Dispersion aufweisen-1.
Aus gesättigten Lösungen dieses Salzes werden große LiF-Kristalle erhalten. Kann natürliche Fluoritkristalle in verschiedenen Arten von optischen Geräten ersetzen.
Große, reine Kristalle werden in optischen Systemen für ultraviolettes (UV), sichtbares und IR-Licht sowie in Röntgenmonochromatoren (0,03-0,38 nm) verwendet..

Aufgrund seines breiten optischen Bandes, das größer ist als das anderer Metallfluoride, wird es auch als optisches Beschichtungsmaterial für den UV-Bereich verwendet..
Aufgrund seiner Transparenz im fernen UV (90-200 nm) eignet es sich ideal als Schutzbeschichtung für Aluminiumspiegel (Al). LiF / Al-Spiegel werden in optischen Teleskopsystemen für Anwendungen im Weltraum verwendet.
Diese Beschichtungen werden durch physikalische Gasphasenabscheidung und Schichtabscheidung auf atomarer Ebene erreicht..
In ionisierenden oder gefährlichen Strahlungsdetektoren
Lithiumfluorid ist in thermolumineszierenden Detektoren für Photonen-, Neutronen- und β (Beta) -Partikelstrahlung weit verbreitet..
Thermolumineszenzdetektoren sparen die Energie der Strahlung, wenn sie dieser ausgesetzt werden. Später setzen sie beim Erhitzen die gespeicherte Energie in Form von Licht frei..
Für diese Anwendung wird das LiF im Allgemeinen mit Magnesium (Mg) - und Titan (Ti) -Verunreinigungen dotiert. Diese Verunreinigungen erzeugen bestimmte Energieniveaus, die als Löcher wirken, in denen die durch Strahlung freigesetzten Elektronen eingefangen werden. Wenn das Material dann erhitzt wird, kehren diese Elektronen in ihren ursprünglichen Energiezustand zurück und emittieren Licht.
Die Intensität des emittierten Lichts hängt direkt von der vom Material absorbierten Energie ab.
Thermolumineszierende LiF-Detektoren wurden erfolgreich getestet, um komplexe Strahlungsfelder zu messen, wie sie im Large Hadron Collider oder LHC vorhanden sind. Large Hadron Collider), ansässig in der Europäischen Organisation für Kernforschung, bekannt als CERN (für sein Akronym aus dem Französischen Conseil Européen pour la Recherche Nucléaire).
Die Strahlung in den in diesem Forschungszentrum durchgeführten Experimenten zeigt unter anderem Hadronen, Neutronen und Elektronen / Positronen, die alle mit LiF nachgewiesen werden können.
Als Material zur Vorliteration der Kathode von Lithiumbatterien
LiF wurde erfolgreich in Form von Nanokompositen mit Kobalt (Co) und Eisen (Fe) als Materialien für die Prälitierung getestet. Prälithiation) des Kathodenmaterials von Lithiumionenbatterien.
Während des ersten Ladezyklus oder der ersten Bildungsstufe einer Lithiumionenbatterie zersetzt sich der organische Elektrolyt unter Bildung einer festen Phase auf der Oberfläche der Anode..
Dieser Prozess verbraucht Lithium aus der Kathode und reduziert die Energie um 5 bis 20% der Gesamtkapazität der Lithiumionenbatterie..
Aus diesem Grund wurde die elektrochemische Vorlitiierung der Kathode untersucht, die eine elektrochemische Extraktion von Lithium aus dem Nanokomposit erzeugt, das als Lithiumdonor fungiert, wodurch der Verbrauch von Lithium aus der Kathode vermieden wird.
LiF / Co- und LiF / Fe-Nanokomposite haben eine hohe Fähigkeit, Lithium an die Kathode abzugeben, sind leicht zu synthetisieren, unter Umgebungsbedingungen stabil und bei der Batterieverarbeitung stabil.

In verschiedenen Anwendungen
Lithiumfluorid wird als Schweißflussmittel, insbesondere Aluminium, und in Beschichtungen für Schweißstäbe verwendet. Wird auch in Aluminiumreduktionszellen verwendet.
Es wird häufig bei der Herstellung von Gläsern (wie Linsen) verwendet, bei denen der Ausdehnungskoeffizient abnimmt. Es wird auch bei der Herstellung von Keramik verwendet. Darüber hinaus wird es zur Herstellung von Emails und Glaslacken verwendet..
LiF ist Bestandteil von Raketentreibstoffen und Brennstoffen für bestimmte Reaktortypen..
LiF wird auch in Leuchtdioden oder Photovoltaikkomponenten zur Injektion von Elektronen in innere Schichten verwendet.
Verweise
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- UNS. Nationalbibliothek für Medizin. (2019). Lithiumfluorid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- B. Obryk et al. (2008). Die Reaktion verschiedener Arten von TL-Lithiumfluorid-Detektoren auf energiereiche gemischte Strahlungsfelder. Radiation Measurements 43 (2008) 1144-1148. Von sciencedirect.com wiederhergestellt.
- Sun, Y. et al. (2016). Chemische In-situ-Synthese von Lithiumfluorid / Metall-Nanokomposit zur Hochkapazitätsprelithiation von Kathoden. Nano Letters 2016, 16, 2, 1497-1501. Von pubs.acs.org wiederhergestellt.
- Hennessy, J. und Nikzad, S. (2018). Atomlagenabscheidung von optischen Lithiumfluorid-Beschichtungen für das Ultraviolett. Anorganika 2018, 6, 46. Von mdpi.com wiederhergestellt.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.