
Festkörpereigenschaften, Eigenschaften, Typen, Beispiele

Das fester Zustand Dies ist eine der Hauptmethoden, mit denen Materie hinzugefügt wird, um kondensierte oder feste Körper zu erzeugen. Die gesamte Erdkruste, die die Meere und Ozeane auslässt, ist ein buntes Konglomerat von Feststoffen. Beispiele für Objekte im festen Zustand sind ein Buch, ein Stein oder Sandkörner.
Dank der Abstoßung unserer Elektronen mit denen ihrer Atome oder Moleküle können wir mit Festkörpern interagieren. Im Gegensatz zu Flüssigkeiten und Gasen können unsere Hände sie nicht durchdringen, sondern zerbröckeln oder absorbieren, solange sie nicht stark giftig sind.

Feststoffe sind im Allgemeinen viel einfacher zu handhaben oder zu lagern als eine Flüssigkeit oder ein Gas. Wenn seine Partikel nicht fein verteilt sind, wird sie von einem Windstrom nicht in andere Richtungen getragen. sind in dem Raum fixiert, der durch die intermolekularen Wechselwirkungen ihrer Atome, Ionen oder Moleküle definiert ist.
Artikelverzeichnis
- 1 Festkörperkonzept
- 2 Allgemeine Eigenschaften von Feststoffen
- 3 Eigenschaften
- 3.1 Schmelzpunkte
- 3.2 Stöchiometrie
- 3.3 Mängel
- 3.4 Reaktivität
- 3.5 Körperlich
- 4 Typen und Beispiele
- 4.1 Kristalline Feststoffe
- 4.2 Amorphe Feststoffe
- 4.3 Ionisch
- 4.4 Metallisch
- 4.5 Atomic
- 4.6 Molekular und polymer
- 4.7 Kovalente Netzwerke
- 5 Referenzen
Solides Konzept
Der Feststoff ist ein Zustand der Materie, in dem es ein starres Volumen und eine starre Form gibt; Die Partikel, die im festen Zustand Materialien oder Objekte bilden, sind an einer Stelle fixiert und nicht leicht komprimierbar.
Dieser Zustand der Materie ist in Bezug auf Chemie und Physik am vielfältigsten und reichhaltigsten. Wir haben ionische, metallische, atomare, molekulare und kovalente Feststoffe mit jeweils eigenen Struktureinheiten. das heißt, mit seinen eigenen Kristallen. Wenn ihre Aggregationsart es ihnen nicht erlaubt, geordnete interne Strukturen aufzubauen, werden sie amorph und kompliziert.
Die Untersuchung des Festkörpers konvergiert beim Design und der Synthese neuer Materialien. Beispielsweise wurde Holz, ein natürlicher Feststoff, auch als Ziermaterial und für den Bau von Häusern verwendet.
Andere feste Materialien ermöglichen die Herstellung von Automobilen, Flugzeugen, Schiffen, Raumschiffen, Kernreaktoren, Sportartikeln, Batterien, Katalysatoren und vielen anderen Gegenständen oder Produkten..
Allgemeine Eigenschaften von Feststoffen

Die Hauptmerkmale von Feststoffen sind:
-Sie haben bestimmte Masse, Volumen und Formen. Ein Gas hat zum Beispiel weder ein Ende noch einen Anfang, da diese von dem Behälter abhängen, in dem es gespeichert ist..
-Sie sind sehr dicht. Feststoffe sind tendenziell dichter als Flüssigkeiten und Gase. Es gibt jedoch einige Ausnahmen von der Regel, insbesondere beim Vergleich von Flüssigkeiten und Feststoffen.
-Die Abstände, die ihre Partikel trennen, sind kurz. Dies bedeutet, dass sie in ihrem jeweiligen Volumen sehr kohäsiv oder verdichtet waren.

-Ihre intermolekularen Wechselwirkungen sind sehr stark, sonst würden sie als solche nicht existieren und unter terrestrischen Bedingungen schmelzen oder sublimieren..

-Die Mobilität von Festkörpern ist normalerweise nicht nur aus materieller, sondern auch aus molekularer Sicht recht begrenzt. Seine Partikel befinden sich in einer festen Position, in der sie nur vibrieren, sich aber nicht bewegen oder drehen können (theoretisch)..
Eigenschaften
Schmelzpunkte
Alle Feststoffe können, sofern sie sich dabei nicht zersetzen und unabhängig davon, ob sie gute Wärmeleiter sind oder nicht, bei einer bestimmten Temperatur in einen flüssigen Zustand übergehen: ihren Schmelzpunkt. Wenn diese Temperatur erreicht ist, können die Partikel schließlich fließen und aus ihren festen Positionen entweichen..
Dieser Schmelzpunkt hängt von der Art des Feststoffs, seinen Wechselwirkungen, der Molmasse und der Kristallgitterenergie ab. In der Regel weisen ionische Feststoffe und kovalente Netzwerke (wie Diamant und Siliziumdioxid) die höchsten Schmelzpunkte auf. während molekulare Feststoffe am niedrigsten sind.
Das folgende Bild zeigt, wie sich ein Eiswürfel (Festkörper) in einen flüssigen Zustand verwandelt:

Stöchiometrie
Ein Großteil der Feststoffe ist molekular, da es sich um Verbindungen handelt, deren intermolekulare Wechselwirkungen es ihnen ermöglichen, auf diese Weise zu verschmelzen. Viele andere sind jedoch ionisch oder teilweise ionisch, so dass ihre Einheiten keine Moleküle, sondern Zellen sind: eine Reihe von Atomen oder Ionen, die in geordneter Weise angeordnet sind..
Hier müssen die Formeln solcher Feststoffe die Neutralität der Ladungen berücksichtigen und ihre Zusammensetzung und stöchiometrischen Beziehungen angeben. Zum Beispiel der Feststoff, dessen hypothetische Formel A istzweiB.4ODERzwei weist darauf hin, dass es die gleiche Anzahl von A-Atomen wie O (2: 2) hat, während es die doppelte Anzahl von B-Atomen hat (2: 4).
Beachten Sie, dass die Indizes der Formel A.zweiB.4ODERzwei Sie sind ganze Zahlen, was zeigt, dass es sich um einen stöchiometrischen Feststoff handelt. Die Zusammensetzung vieler Feststoffe wird durch diese Formeln beschrieben. Die Ladungen von A, B und O müssen gleich Null addieren, da sonst eine positive oder negative Ladung vorliegt.
Für Feststoffe ist es besonders nützlich zu wissen, wie ihre Formeln zu interpretieren sind, da im Allgemeinen die Zusammensetzungen von Flüssigkeiten und Gasen einfacher sind.
Mängel
Die Strukturen von Festkörpern sind nicht perfekt; Sie weisen Unvollkommenheiten oder Defekte auf, wie kristallin sie auch sein mögen. Dies ist bei Flüssigkeiten oder Gasen nicht der Fall. Es gibt keine Regionen mit flüssigem Wasser, die im Voraus bestätigt werden können und die in Bezug auf ihre Umgebung "verschoben" sind..
Solche Defekte sind dafür verantwortlich, dass die Feststoffe hart und spröde sind, Eigenschaften wie Pyroelektrizität und Piezoelektrizität aufweisen oder keine definierten Zusammensetzungen mehr haben; das heißt, sie sind nichtstöchiometrische Feststoffe (zum Beispiel A.0,4B.1.3ODER0,5).
Reaktivität
Feststoffe sind normalerweise weniger reaktiv als Flüssigkeiten und Gase; aber nicht aufgrund chemischer Ursachen, sondern aufgrund der Tatsache, dass ihre Strukturen verhindern, dass Reaktanten die Partikel in ihnen angreifen und zuerst mit denen auf ihrer Oberfläche reagieren. Daher sind Reaktionen mit Feststoffen tendenziell langsamer. es sei denn, sie sind pulverisiert.
Wenn ein Feststoff in Pulverform vorliegt, haben seine kleineren Partikel eine größere Fläche oder Oberfläche, um zu reagieren. Aus diesem Grund werden feine Feststoffe häufig als potenziell gefährliche Reagenzien bezeichnet, da sie sich schnell entzünden oder bei Kontakt mit anderen Substanzen oder Verbindungen heftig reagieren können..
Feststoffe werden häufig in einem Reaktionsmedium gelöst, um das System zu homogenisieren und eine Synthese mit höherer Ausbeute durchzuführen..
Körperlich
Mit Ausnahme des Schmelzpunktes und der Defekte entspricht das bisher Gesagte eher den chemischen Eigenschaften von Feststoffen als ihren physikalischen Eigenschaften. Die Physik von Materialien konzentriert sich stark darauf, wie Licht, Schall, Elektronen und Wärme mit Festkörpern interagieren, ob sie kristallin, amorph, molekular usw. sind..
Hier kommen sogenannte plastische, elastische, starre, undurchsichtige, transparente, supraleitende, photoelektrische, mikroporöse, ferromagnetische, isolierende oder Halbleiterfeststoffe ins Spiel..
In der Chemie sind beispielsweise Materialien von Interesse, die keine ultraviolette Strahlung oder sichtbares Licht absorbieren, da sie zur Herstellung von Messzellen für UV-Vis-Spektrophotometer verwendet werden. Das gleiche passiert mit Infrarotstrahlung, wenn Sie eine Verbindung durch Erhalten ihres IR-Spektrums charakterisieren oder den Fortschritt einer Reaktion untersuchen möchten.
Die Untersuchung und Manipulation aller physikalischen Eigenschaften von Festkörpern erfordert ein enormes Engagement sowie deren Synthese und Design, wobei "Stücke" anorganischer, biologischer, organischer oder metallorganischer Konstruktion für neue Materialien ausgewählt werden.
Typen und Beispiele
Da es chemisch mehrere Arten von Feststoffen gibt, werden repräsentative Beispiele für jede separat aufgeführt..
Kristalline Feststoffe
Einerseits gibt es kristalline Feststoffe. Diese Elemente sind dadurch gekennzeichnet, dass die Moleküle, aus denen sie bestehen, auf dieselbe Weise konfiguriert sind, was sich als Muster im gesamten Kristall wiederholt. Jedes Muster wird als Einheitszelle bezeichnet.
Kristalline Feststoffe zeichnen sich auch durch einen definierten Schmelzpunkt aus; Dies bedeutet, dass aufgrund der Gleichmäßigkeit der Anordnung ihrer Moleküle zwischen jeder Einheitszelle der gleiche Abstand besteht, wodurch sich die gesamte Struktur unter der gleichen Temperatur ständig umwandeln kann..
Beispiele für kristalline Feststoffe können Salz und Zucker sein..
Amorphe Feststoffe
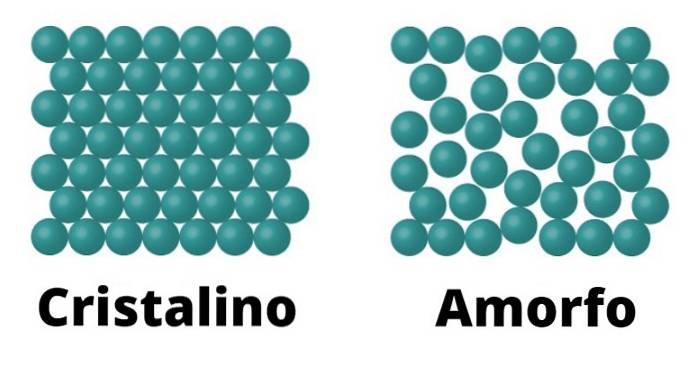
Amorphe Feststoffe zeichnen sich dadurch aus, dass die Konformation ihrer Moleküle nicht auf ein Muster reagiert, sondern über die gesamte Oberfläche variiert.
Da es kein solches Muster gibt, ist der Schmelzpunkt amorpher Feststoffe im Gegensatz zu kristallinen nicht definiert, was bedeutet, dass sie allmählich und unter verschiedenen Temperaturen schmelzen..
Beispiele für amorphe Feststoffe können Glas und die meisten Kunststoffe sein.
Ionics
Ionische Feststoffe zeichnen sich durch Kationen und Anionen aus, die durch elektrostatische Anziehung (Ionenbindung) miteinander interagieren. Wenn die Ionen klein sind, sind die resultierenden Strukturen normalerweise immer kristallin (unter Berücksichtigung ihrer Defekte). Unter einigen ionischen Feststoffen haben wir:
-NaCl (Na+Cl-), Natriumchlorid
-MgO (Mgzwei+ODERzwei-), Magnesiumoxid
-Dieb3 (ACzwei+CO3zwei-), Kalziumkarbonat
-KURS4 (Cuzwei+SW4zwei-), Kupfersulfat
-KF (K.+F.-), Kaliumfluorid
-NH4Cl (NH4+Cl-), Ammoniumchlorid
-ZnS (Znzwei+S.zwei-), Zinksulfid
-Fe (C.6H.5GURREN)3, Eisenbenzoat
Metallisch
Wie der Name schon sagt, handelt es sich um Feststoffe mit Metallatomen, die über die Metallbindung interagieren:
-Silber
-Gold
-Führen
-Messing
-Bronze
-Weißes Gold
-Zinn
-Stähle
-Duraluminium
Beachten Sie, dass Legierungen offensichtlich auch als metallische Feststoffe gelten.
Atomic
Metallische Feststoffe sind ebenfalls atomar, da theoretisch keine kovalenten Bindungen zwischen Metallatomen (M-M) bestehen. Edelgase zählen jedoch im Wesentlichen als Atomspezies, da nur die Londoner Dispersionskräfte unter ihnen überwiegen..
Daher sind kristallisierte Edelgase Beispiele für atomare Feststoffe, obwohl sie keine Feststoffe mit hohem Anwendungsgrad sind (und schwer zu erhalten sind). Helium, Neon, Argon, Krypton usw., Feststoffe.
Molekular und polymer
Moleküle können durch Van-der-Walls-Kräfte interagieren, wobei ihre Molekularmassen, Dipolmomente, Wasserstoffbrücken, Strukturen und Geometrien eine wichtige Rolle spielen. Je stärker solche Wechselwirkungen sind, desto wahrscheinlicher ist es, dass sie in Form eines Feststoffs vorliegen.
Andererseits gilt die gleiche Überlegung für Polymere, die aufgrund ihrer hohen durchschnittlichen Molekularmassen fast immer Feststoffe sind und von denen einige amorph sind; da seine polymeren Einheiten es schwierig finden, sich selbst anzuordnen, um Kristalle zu erzeugen.
Daher haben wir unter einigen molekularen und polymeren Feststoffen Folgendes:
-Trockeneis

-Zucker
-Jod
-Benzoesäure
-Acetamid
-Rhombischer Schwefel
-Palmitinsäure
-Fullerene
-Spiel
-Koffein
-Naphthalin
-Holz und Papier
-Die Seide
-Teflon
-Polyethylen
-Kevlar
-Bakelit
-Polyvinylchlorid
-Polystyrol
-Polypropylen
-Protein
-Schokoladenriegel
Kovalente Netzwerke
Schließlich haben wir die kovalenten Netzwerke zwischen den härtesten und am höchsten schmelzenden Feststoffen. Einige Beispiele sind:
-Graphit
-Diamant
-Quarz
-Siliciumcarbid
-Bornitrid
-Aluminiumphosphid
-Galliumarsenid
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2019). Festkörperchemie. Wiederhergestellt von: en.wikipedia.org
- Elsevier B.V. (2019). Festkörperchemie. ScienceDirect. Wiederhergestellt von: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Vorlesungsunterlagen zur Festkörperchemie. Wiederhergestellt von: unf.edu
- askIITians. (2019). Allgemeine Eigenschaften von Festkörpern. Wiederhergestellt von: askiitians.com
- David Wood. (2019). Wie Atome und Moleküle Feststoffe bilden: Muster und Kristalle. Studie. Wiederhergestellt von: study.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.