
Sigma Link Wie es gebildet wird, Eigenschaften und Beispiele
Das Sigma Link (dargestellt als & sgr;) ist eine kovalente Vereinigung, die durch das Teilen von zwei Elektronen gekennzeichnet ist, das zwischen einem Paar von Atomen auftritt, um die Bindung zu bilden. Darüber hinaus ist dies eine Art Einfachbindung, bei der beide Atome durch zwei Elektronen zu einer Einfachbindung verbunden sind..
Wenn zwei oder mehr Atome kombiniert werden, um neue molekulare Verbindungen zu bilden, werden sie über zwei Arten von Bindungen verbunden: ionisch und kovalent, deren Struktur davon abhängt, wie die Elektronen zwischen beiden an dieser Kopplung beteiligten Atomen geteilt werden..
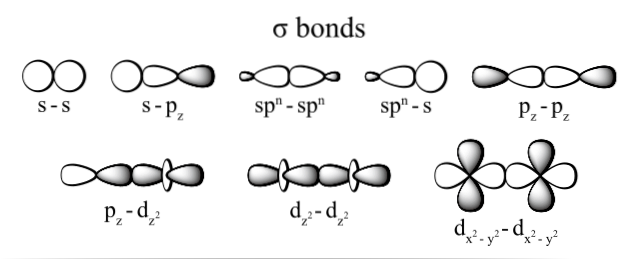
Die durch die Elektronen erzeugte Verbindung wird dank der Überlappung der Orbitale hergestellt, die zu jedem Atom gehören (an ihren Enden), wobei als Orbitale die Räume verstanden werden, in denen das Elektron am wahrscheinlichsten im Atom lokalisiert ist und die durch Elektronen definiert sind Dichte.
Artikelverzeichnis
- 1 Wie entsteht es??
- 1.1 Bildung von Sigma-Bindungen in verschiedenen chemischen Spezies
- 2 Funktionen
- 3 Beispiele
- 4 Referenzen
Wie ist es gebildet?
Typischerweise ist bekannt, dass die Einfachbindung zwischen zwei Atomen einer einzelnen Sigma-Bindung entspricht..
Ebenso entstehen diese Bindungen aufgrund der Überlagerung oder Überlappung in frontaler Weise, die zwischen den Enden der Atomorbitale zweier verschiedener Atome auftritt..
Diese Atome, deren Orbitale sich überlappen, müssen nebeneinander liegen, damit die einzelnen Elektronen, die zu jedem Atomorbital gehören, effektiv binden und die Bindung bilden können..
Daher hat die Tatsache, dass die elektronische Verteilung, die sich manifestiert, oder der Ort der Dichte der Elektronen aus jeder Überlagerung eine zylindrische Symmetrie um die Achse, die zwischen den beiden verbundenen Atomspezies auftritt..
In diesem Fall kann das sogenannte Sigma-Orbital leichter als intramolekulare Bindungen ausgedrückt werden, die sich innerhalb von zweiatomigen Molekülen bilden, wobei zu beachten ist, dass es auch verschiedene Arten von Sigma-Bindungen gibt..
Die am häufigsten beobachteten Arten von Sigma-Bindungen sind: dzzwei+dzzwei, s + pz, pz+pz und s + s; wobei der Index z die Achse darstellt, die aus der gebildeten Bindung besteht, und jeder Buchstabe (s, p und d) einem Orbital entspricht.
Bildung von Sigma-Bindungen in verschiedenen chemischen Spezies
Wenn es um Molekülorbitale geht, wird auf die Regionen Bezug genommen, die die höchste Elektronendichte akkumulieren, wenn eine Bindung dieses Typs zwischen verschiedenen Molekülen gebildet wird, die durch die Kombination von Atomorbitalen erhalten wird..
Aus quantenmechanischer Sicht haben Studien gefolgert, dass Orbitale vom molekularen Typ, die ein symmetrisch gleiches Verhalten aufweisen, tatsächlich in Gemischen (Hybridisierungen) kombiniert werden..
Die Bedeutung dieser Kombination von Orbitalen hängt jedoch eng mit den relativen Energien zusammen, die sich in symmetrisch ähnlichen Orbitalen vom molekularen Typ manifestieren..
Bei organischen Molekülen werden häufig cyclische Spezies beobachtet, die aus einer oder mehreren Ringstrukturen bestehen und häufig aus einer großen Anzahl von Sigma-Bindungen in Verbindung mit Pi-Bindungen (Mehrfachbindungen) bestehen..
Tatsächlich ist es mit einfachen mathematischen Berechnungen möglich, die Anzahl der in einer molekularen Spezies vorhandenen Sigma-Bindungen zu bestimmen..
Es gibt auch Fälle von Koordinationsverbindungen (mit Übergangsmetallen), bei denen Mehrfachbindungen mit verschiedenen Klassen von Bindungswechselwirkungen kombiniert werden, sowie Moleküle, die aus verschiedenen Arten von Atomen bestehen (mehratomig).
Eigenschaften
Sigma-Bindungen weisen einzigartige Eigenschaften auf, die sie deutlich von anderen Arten der kovalenten Bindung (pi-Bindung) unterscheiden. Dazu gehört die Tatsache, dass diese Art der Bindung die stärkste unter den chemischen Bindungen der kovalenten Klasse ist.
Dies liegt daran, dass die Überlappung zwischen den Orbitalen direkt, koaxial (oder linear) und frontal auftritt; Das heißt, eine maximale Überlappung wird zwischen den Orbitalen erhalten.
Zusätzlich konzentriert sich die elektronische Verteilung an diesen Übergängen hauptsächlich zwischen den Kernen der kombinierten Atomspezies..
Diese Überlappung von Sigma-Orbitalen tritt auf drei mögliche Arten auf: zwischen einem Paar reiner Orbitale (s-s), zwischen einem reinen Orbital und einem Hybridtyp (s-sp) oder zwischen einem Paar Hybridorbitalen (sp)3- sp3).
Die Hybridisierung erfolgt dank der Mischung von Orbitalen atomaren Ursprungs verschiedener Klassen, wodurch erhalten wird, dass das resultierende Hybridorbital von der Menge jedes der Typen von reinen Ausgangsorbitalen abhängt (z. B. sp3 = ein reines s-Orbital + drei reine p-Orbitale).
Darüber hinaus kann die Sigma-Bindung unabhängig voneinander existieren und eine freie Rotationsbewegung zwischen einem Atompaar zulassen..
Beispiele
Da die kovalente Bindung die häufigste Art der Bindung zwischen Atomen ist, findet sich die Sigma-Bindung in einer großen Anzahl chemischer Spezies, wie unten zu sehen ist.
In zweiatomigen Gasmolekülen - wie Wasserstoff (H.zwei), Sauerstoff (O.zwei) und Stickstoff (N.zwei) - Je nach Hybridisierung der Atome können unterschiedliche Bindungsarten auftreten.
Im Fall von Wasserstoff gibt es eine einzelne Sigma-Bindung, die beide Atome (H-H) verbindet, da jedes Atom sein einziges Elektron beisteuert.
Andererseits sind in molekularem Sauerstoff beide Atome durch eine Doppelbindung (O = O) - das heißt eine Sigma-Bindung - und eine Pi-Bindung verbunden, wobei jedes Atom drei Paare verbleibender Elektronenpaare aufweist.
Stattdessen hat jedes Stickstoffatom fünf Elektronen in seinem äußersten Energieniveau (Valenzschale), so dass sie durch eine Dreifachbindung (N≡N) verbunden sind, was das Vorhandensein einer Sigma-Bindung und zweier pi-Bindungen und eines Paares gepaarter Elektronen impliziert in jedem Atom.
In gleicher Weise kommt es in Verbindungen vom cyclischen Typ mit Einfach- oder Mehrfachbindungen und in allen Arten von Molekülen vor, deren Struktur aus kovalenten Bindungen besteht..
Verweise
- Wikipedia. (s.f.). Sigma-Bindung. Von en.wikipedia.org wiederhergestellt
- Chang, R. (2007). Chemie, 9. Auflage. Mexiko: McGraw-Hill.
- ThoughtCo. (s.f.). Definition der Sigma-Bindungschemie. Von gedankenco.com wiederhergestellt
- Britannica, E. (s.f.). Sigma-Bindung. Von britannica.com abgerufen
- LibreTexts. (s.f.). Sigma- und Pi-Anleihen. Von chem.libretexts.org wiederhergestellt
- Srivastava, A. K. (2008). Organische Chemie leicht gemacht. Von books.google.co.ve wiederhergestellt



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.