
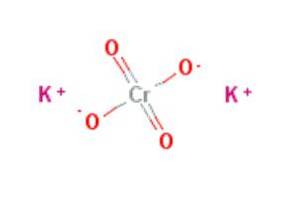
Eigenschaften, Risiken und Verwendungen von Kaliumchromat (K2CrO4)
Das Kaliumchromat ist eine anorganische Verbindung der Formel K.zweiCrO4, gekennzeichnet durch ein starkes Oxidationsmittel. Es wird hergestellt, indem Kaliumdichromat mit Kaliumhydroxid gemäß der Reaktion behandelt wird: K.zweiCrO7 + 2KOH → 2KzweiCrO4 + H.zweiODER.
Als Verbindung mit einem relativ einzigartigen Profil hat Kaliumchromat eine Reihe von Anwendungen in industriellen und wissenschaftlichen Kontexten. Aufgrund seiner Toxizität sollte seine Exposition jedoch begrenzt werden (JACOBS, 2015)..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften
Kaliumchromat sind orthorhombische Kristalle von gelblicher Farbe, denen ein charakteristisches Aroma fehlt und die einen unangenehmen bitteren Geschmack haben (Nationales Zentrum für Biotechnologie-Informationen, 2017)..

Sein Molekulargewicht beträgt 194,19 g / mol und seine Dichte 2,7320 g / ml. Es hat einen Schmelzpunkt von 968 ° C und einen Siedepunkt von 1000 ° C..
Die Verbindung ist in Alkohol unlöslich und in Wasser sehr gut löslich und kann 62,9 Gramm pro 100 ml Lösungsmittel bei 20 ° C lösen (Royal Society of Chemistry, 2015)..
Reaktivität und Gefahren
Oxidationsmittel wie Kaliumchromat können mit Reduktionsmitteln reagieren, um Wärme und Produkte zu erzeugen, die gasförmig sein können (wodurch geschlossene Behälter unter Druck gesetzt werden)..
Produkte können zusätzliche Reaktionen hervorrufen (z. B. Verbrennung in Luft). Die chemische Reduktion von Materialien in dieser Gruppe kann schnell oder sogar explosiv sein, erfordert jedoch häufig eine Initiierung (Wärme, Funken, Katalysator, Zugabe eines Lösungsmittels)..
Explosive Gemische von anorganischen Oxidationsmitteln mit Reduktionsmitteln bleiben oft über lange Zeiträume unverändert, wenn eine Initiierung vermieden wird. Solche Systeme sind typischerweise Gemische von Feststoffen, können jedoch eine beliebige Kombination physikalischer Zustände beinhalten. Einige anorganische Oxidationsmittel sind in Wasser lösliche Metallsalze..
Die Auflösung nimmt ab, hebt jedoch die Oxidationskraft solcher Materialien nicht auf. Organische Verbindungen haben im Allgemeinen eine gewisse Reduktionskraft und können im Prinzip mit Verbindungen dieser Klasse reagieren.
Die tatsächliche Reaktivität variiert stark mit der Identität der organischen Verbindung. Anorganische Oxidationsmittel können heftig mit aktiven Metallen, Cyaniden, Estern und Thiocyanaten reagieren.
Die Verbindung stellt eine Gefahr für die Umwelt dar. Es müssen sofort Maßnahmen ergriffen werden, um die Ausbreitung darauf zu beschränken. Wenn Kaliumchromat überall und für jeden Zweck verwendet wird, muss es wirksam zurückgehalten und entsorgt werden, um ein Abfließen oder Auslaufen in die Umwelt zu verhindern..
Zusätzlich kann Kaliumchromat die Intensität eines Feuers erhöhen, wenn die Chemikalie mit brennbaren Materialien in Kontakt kommt. Die Verbindung setzt beim Erhitzen giftige Chromdämpfe frei (POTASSIUM CHROMATE, 2016).
Kaliumchromat ist stark ätzend und ein starkes Oxidationsmittel. Es betrifft hauptsächlich Nase, Rachen und Lunge und verursacht Geschwüre, Atemnot, Bronchitis, Lungenentzündung und Asthma, kann aber auch den Magen-Darm-Trakt, die Leber, die Nieren und das Immunsystem betreffen..
Diese Substanz ist ein bekanntes menschliches Karzinogen und mit einem erhöhten Risiko für die Entwicklung von Lungenkrebs und Krebs in der Sinonasalhöhle verbunden (Kaliumchromat, 2016)..
Seine geruchlose Natur wird problematisch, wenn es aufgrund seiner Toxizität dieser Chemikalie ausgesetzt wurde. In vielen Fällen ist Ihnen möglicherweise nicht bewusst, dass Sie Kaliumchromat eingeatmet haben..
Darüber hinaus birgt das Einatmen dieser Chemikalie mehrere Risiken. Zu den Symptomen gehören Übelkeit, Erbrechen, Bauchschmerzen, Brennen, Durchfall, Schock oder Kollaps..
Bei Kontakt mit den Augen sollten die Kontaktlinsen überprüft und entfernt werden. Dann ist es notwendig, die Augen sofort mindestens 15 Minuten lang mit kaltem Wasser mit viel Wasser zu waschen.
Bei Hautkontakt sollte der betroffene Bereich sofort mindestens 15 Minuten lang mit viel Wasser gespült werden, während kontaminierte Kleidung und Schuhe entfernt werden. Bedecken Sie gereizte Haut mit einem Weichmacher.
Waschen Sie Kleidung und Schuhe vor der Wiederverwendung. Bei starkem Kontakt mit einer Desinfektionsseife waschen und die kontaminierte Haut mit einer antibakteriellen Creme abdecken.
Bei Inhalation sollte das Opfer an einen kühlen Ort gebracht werden. Wenn nicht geatmet wird, wird künstlich beatmet.
Wenn die Verbindung eingenommen wird, sollte kein Erbrechen ausgelöst werden, es sei denn, dies wird vom medizinischen Personal angeordnet. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte.
In allen Fällen sollte sofort ein Arzt aufgesucht werden (Sicherheitsdatenblatt Kaliumchromat, 2013)..
Anwendungen
Kaliumchromat genießt eine Vielzahl industrieller Anwendungen. In der Textilindustrie verwenden Hersteller Kaliumchromat, um Leder zu bräunen und Kleidungsstücke und Stoffe zu färben (Dye, 2017)..
Es wirkt auch als Oxidationsmittel in der Industrie und in der organischen Synthese. Es wird medizinisch als äußeres Antiseptikum oder Adstringens verwendet und ist in einigen Tierarzneimitteln enthalten.
Kaliumchromat wird als Indikator bei der Bestimmung von Chlorid durch Titration mit Standard-Silbernitratlösung verwendet. Diese Methode wird als Mohrsche Methode zur Chloridbestimmung bezeichnet..
Dieses Verfahren beruht auf der Bildung eines roten Silberchromatniederschlags am Endpunkt, nachdem das gesamte Chlorid als weißes Silberchlorid ausgefällt ist..
Üblicherweise wird eine 5% ige Lösung von Kaliumchromat verwendet, die mit Chlorid neutralisiert wurde. Pro 100 ml Probenvolumen sollte ca. 1 ml dieses Indikators verwendet werden (RICCA Chemical Company, 2015). Die Reaktionen für die Mohr-Titration sind:
Ag+ + Cl- → AgCl (weißer Niederschlag)
2 Ag+ (Überschuss) + CrO4zwei- → AgzweiCrO4 (roter Niederschlag am Endpunkt)
Verweise
- Dye, J. L. (2017, 1. März). Kalium (K) CHEMISCHES ELEMENT. Aus der Enzyklopädie britannica.com wiederhergestellt.
- JACOBS, J. (2015, 3. August). Wofür wird Kaliumchromat verwendet? Von livestrong.com wiederhergestellt.
- Sicherheitsdatenblatt Kaliumchromat. (2013, 21. Mai). Von sciencelab.com wiederhergestellt.
- Nationales Zentrum für Informationen zur Biotechnologie. (2017, 4. März). PubChem Compound Database; CID = 24597. Von PubChem abgerufen.
- Kaliumchromat. (2016, 27. Februar). Von NCIt wiederhergestellt.
- POTASSIUMCHROMAT. (2016). Aus Cameochemikalien gewonnen.
- RICCA Chemical Company. (2015). Kaliumchromat. Von Riccachemical erholt.
- Royal Society of Chemistry. (2015). Kaliumchromat. Von chemspider.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.