
Galvanische Korrosionsmechanismen, Beispiele, Schutz
Das galvanische oder elektrochemische Korrosion Es ist ein Prozess, bei dem ein Metall oder eine Legierung im Vergleich zu ihrer herkömmlichen Oxidation schneller abgebaut wird. Man kann sagen, dass es sich um eine beschleunigte Oxidation handelt, die sogar absichtlich besänftigt wird. wie es in Zellen oder Batterien passiert.
Dies erfolgt unter einer Reihe von Bedingungen. Erstens muss es ein aktives Metall geben, das Anode genannt wird. Und zweitens muss es ein schwach reaktives Edelmetall geben, das als Kathode bezeichnet wird. Die dritte und vierte Bedingung sind das Vorhandensein eines Mediums, in dem sich Elektronen ausbreiten, wie Wasser und ionische Spezies oder Elektrolyte..

Galvanische Korrosion ist insbesondere in Meeresumgebungen oder an den Ufern von Stränden zu beobachten. Luftströmungen erhöhen Massen von Wasserdampf, die wiederum einige Ionen tragen; Letztere haften am Ende an einer dünnen Wasserschicht oder Tropfen, die auf der Metalloberfläche aufliegen.
Diese Bedingungen von Feuchtigkeit und Salzgehalt begünstigen die Korrosion des Metalls. Das heißt, eine Eisenkrone wie die im Bild oben rostet schneller, wenn sie der Nähe des Meeres ausgesetzt wird..
Die Leichtigkeit, mit der ein Metall im Vergleich zu einem anderen oxidieren muss, kann durch seine Reduktionspotentiale quantitativ gemessen werden. Chemiebücher sind reich an Tabellen mit diesen Potentialen E. Je negativer es ist, desto größer ist seine Neigung zum Rosten.
Befindet sich dieses Metall in Gegenwart eines anderen mit einem sehr positiven Reduktionspotential und damit einem großen ΔE, ist die Oxidation des reaktiven Metalls ebenfalls aggressiver. Andere Faktoren wie der pH-Wert, die Ionenstärke, die Luftfeuchtigkeit, das Vorhandensein von Sauerstoff und die Beziehung zwischen den Bereichen des Metalls, die oxidiert und reduziert werden, sind ebenfalls wichtig..
Artikelverzeichnis
- 1 Mechanismen
- 1.1 Konzepte und Reaktionen
- 1.2 Depolarisatoren
- 1.3 Eisenkorrosion
- 2 Beispiele
- 2.1 Anodische Indizes
- 3 Schutz vor elektrochemischer Korrosion
- 3.1 Opferbeschichtungen
- 3.2 Edelbeschichtungen
- 4 Experiment für Kinder
- 4.1 Eisenplatte in Lösung von Kupfersalzen
- 4.2 Silberoxid reinigen
- 5 Referenzen
Mechanismen
Konzepte und Reaktionen
Bevor auf die Mechanismen der galvanischen Korrosion eingegangen wird, sollten bestimmte Konzepte geklärt werden.
Bei einer Redoxreaktion verliert eine Spezies Elektronen (oxidiert), während eine andere sie gewinnt (reduziert). Die Elektrode, an der Oxidation auftritt, wird Anode genannt; und auf dem die Reduktion auftritt, Kathode (auf Englisch die Gedächtnisregel rote Katze erinnern).
Wenn also für eine Elektrode (ein Stück, eine Schraube usw.) eines Metalls M oxidiert wird, heißt es, dass es die Anode ist:
M => M.n+ + ne-
Die Anzahl der freigesetzten Elektronen entspricht der Größe der positiven Ladung des Kations M.n+ resultierend.
Dann empfängt eine andere Elektrode oder ein anderes Metall R (beide Metalle müssen auf irgendeine Weise in Kontakt sein) die freigesetzten Elektronen; Dies reagiert jedoch nicht chemisch, wenn es Elektronen gewinnt, da es diese nur leiten würde (elektrischer Strom)..
Daher muss es eine andere Spezies in Lösung geben, die diese Elektronen formal aufnehmen kann; als leicht reduzierte Metallionen, zum Beispiel:
R.n+ + ne- => R.
Das heißt, eine Metallschicht R würde sich bilden und die Elektrode würde daher schwerer werden; während das Metall M aufgrund der Auflösung seiner Atome an Masse verlieren würde.
Depolarisatoren
Was wäre, wenn es keine Metallkationen gäbe, die leicht genug reduziert werden könnten? In diesem Fall nehmen andere im Medium vorhandene Spezies die Elektronen auf: die Depolarisatoren. Diese stehen in engem Zusammenhang mit pH: O.zwei, H.+, Oh- und H.zweiODER.
Sauerstoff und Wasser gewinnen Elektronen in einer Reaktion, die durch die folgende chemische Gleichung ausgedrückt wird:
ODERzwei + 2HzweiO + 4e- => 4OH-
Während die H-Ionen+ in H verwandelnzwei::
2H+ + 2e- => H.zwei
Das heißt, die Art OH- und H.zwei sind übliche Produkte der galvanischen oder elektrochemischen Korrosion.
Selbst wenn das Metall R an keiner Reaktion beteiligt ist, fördert die Tatsache, dass es edler als M ist, seine Oxidation; und folglich wird es eine höhere Produktion von OH-Ionen geben- oder Wasserstoffgas. Denn schließlich ist der Unterschied zwischen den Reduktionspotentialen ΔE einer der Haupttreiber dieser Prozesse.
Eisenkorrosion
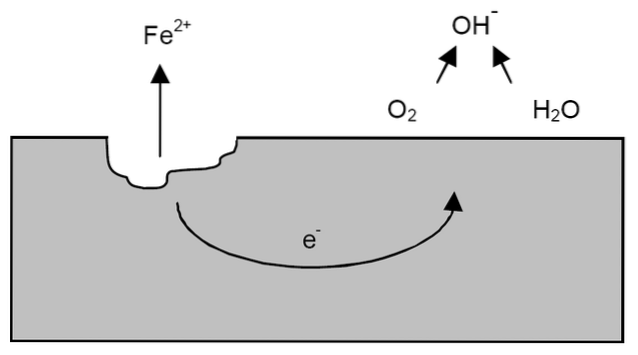
Nach den vorherigen Erläuterungen kann das Beispiel der Eisenkorrosion angesprochen werden (oberes Bild). Angenommen, es gibt eine dünne Wasserschicht, in der sich Sauerstoff löst. Ohne die Anwesenheit anderer Metalle werden die Depolarisatoren die Richtlinien für die Reaktion festlegen.
Somit verliert Eisen einige Atome von seiner Oberfläche, um sich als Fe-Kationen in Wasser zu lösen.zwei+::
Glaube => Glaubezwei+ + 2e-
Die beiden Elektronen wandern durch das Stück Eisen, weil es ein guter Stromleiter ist. Wo also die Oxidation oder die Anodenstelle begann, ist bekannt; aber nicht dort, wo die Reduktion stattfinden wird oder wo sich die kathodische Stelle befindet. Die Kathodenstelle kann überall sein; und je größer die mögliche Fläche ist, desto schlechter korrodiert das Metall.
Angenommen, die Elektronen erreichen einen Punkt, wie im obigen Bild gezeigt. Dort durchlaufen sowohl Sauerstoff als auch Wasser die bereits beschriebene Reaktion, bei der OH freigesetzt wird-. Diese OH-Anionen- kann mit dem Fe reagierenzwei+ Fe (OH) zu bildenzwei, welches ausfällt und nachfolgenden Oxidationen unterliegt, die es schließlich in Rost umwandeln.
Inzwischen knackt die Anodenstelle immer mehr.
Beispiele
Im Alltag gibt es zahlreiche Beispiele für galvanische Korrosion. Wir müssen uns nicht auf die Eisenkrone beziehen: Jedes Artefakt aus Metallen kann in feuchten und salzigen Umgebungen denselben Prozess durchlaufen.
Neben dem Strand bietet der Winter auch ideale Bedingungen für Korrosion. Zum Beispiel beim Schaufeln von Salz in den Schnee auf der Straße, um ein Schleudern der Autos zu verhindern.
Aus physikalischer Sicht kann Feuchtigkeit in den Schweißverbindungen zweier Metalle zurückgehalten werden, die aktive Korrosionsstellen sind. Dies liegt daran, dass sich beide Metalle wie zwei Elektroden verhalten und die reaktivere ihre Elektronen verliert..
Wenn die Produktion von OH-Ionen- Es ist beträchtlich, es kann sogar den Lack des Autos oder des betreffenden Geräts angreifen.
Anodische Indizes
Man kann seine eigenen Beispiele für galvanische Korrosion bauen, indem man die Reduktionspotentialtabellen verwendet. Die anodische Indextabelle (an sich vereinfacht) wird jedoch ausgewählt, um diesen Punkt zu veranschaulichen..
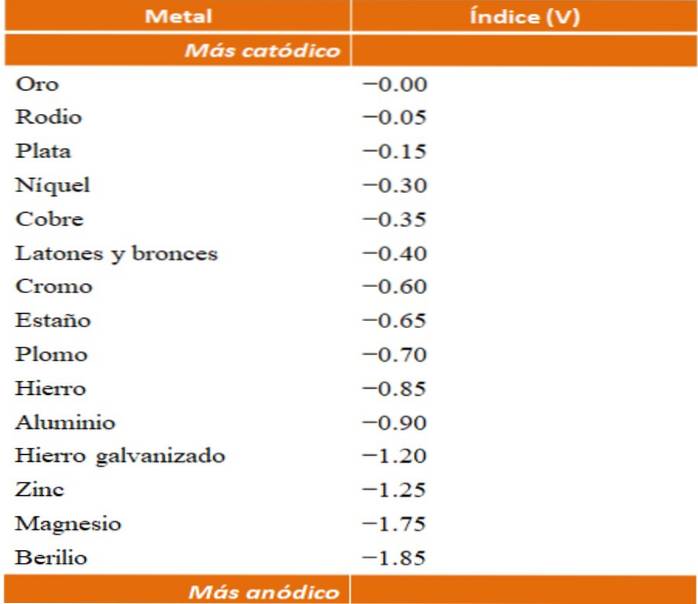
Nehmen wir zum Beispiel an, wir wollten eine elektrochemische Zelle bauen. Die Metalle, die oben in der anodischen Indextabelle stehen, sind kathodischer. das heißt, sie sind leicht zu reduzieren und es wird daher schwierig sein, sie in Lösung zu haben. Während die Metalle, die sich am Boden befinden, anodischer oder reaktiver sind und leicht korrodieren.
Wenn wir Gold und Beryllium wählen, könnten beide Metalle nicht lange zusammen sein, da Beryllium extrem schnell oxidieren würde..
Und wenn wir andererseits eine Lösung von Ag-Ionen haben+ und wir tauchen einen Aluminiumstab hinein, der sich gleichzeitig auflöst, wenn metallische Silberpartikel ausfallen. Wenn dieser Stab mit einer Graphitelektrode verbunden wäre, würden Elektronen dorthin wandern, um Silber als Silberfilm elektrochemisch darauf abzuscheiden..
Und wenn anstelle des Aluminiumstabs Kupfer verwendet würde, würde die Lösung aufgrund der Anwesenheit von Cu-Ionen bläulich werden.zwei+ im Wasser.
Elektrochemischer Korrosionsschutz
Opferbeschichtungen
Angenommen, Sie möchten eine Zinkplatte in Gegenwart anderer Metalle vor Korrosion schützen. Die einfachste Möglichkeit wäre die Zugabe von Magnesium, das das Zink so beschichtet, dass die vom Magnesium freigesetzten Elektronen nach der Oxidation die Zn-Kationen reduzieren.zwei+ zurück.
Der MgO-Film auf Zink würde jedoch eher früher als später reißen und Anodenstellen mit hoher Stromdichte bereitstellen; das heißt, die Korrosion des Zinks würde sich genau an diesen Punkten stark beschleunigen.
Diese elektrochemische Korrosionsschutztechnik ist als Verwendung von Opferbeschichtungen bekannt. Das bekannteste ist Zink, das in der berühmten Technik des Verzinkens verwendet wird. In ihnen ist das Metall M, insbesondere Eisen, mit Zink (Fe / Zn) beschichtet..
Wieder oxidiert das Zink und sein Oxid dient dazu, das Eisen zu bedecken und Elektronen darauf zu übertragen, die das Fe reduzierenzwei+ das kann gebildet werden.
Edle Beschichtungen
Angenommen, Sie möchten dieselbe Zinkfolie schützen, aber jetzt verwenden Sie Chrom anstelle von Magnesium. Chrom ist edler (kathodischer, siehe Tabelle der anodischen Indizes) als Zink und wirkt daher als edle Beschichtung.
Das Problem bei dieser Art von Beschichtung besteht darin, dass sie nach dem Reißen die Oxidation des darunter liegenden Metalls weiter fördert und beschleunigt. In diesem Fall würde das Zink noch stärker korrodieren als mit Magnesium beschichtet zu sein.
Und schließlich gibt es noch andere Beschichtungen, die aus Farben, Kunststoffen, Antioxidantien, Fetten, Harzen usw. bestehen..
Experiment für Kinder
Eisenplatte beim Auflösen von Kupfersalzen
Ein einfaches Experiment kann aus derselben Tabelle von Anodenindizes erstellt werden. Auflösen einer angemessenen Menge (weniger als 10 g) CuSO45HzweiOder im Wasser wird ein Kind gebeten, in eine polierte Eisenplatte einzutauchen. Ein Foto wird aufgenommen und der Vorgang kann sich einige Wochen lang entfalten.
Die Lösung ist anfangs bläulich, beginnt jedoch zu verblassen, während die Eisenplatte eine kupferfarbene Farbe annimmt. Dies liegt daran, dass Kupfer edler als Eisen ist und daher seine Kationen Cuzwei+ Sie werden aus den Ionen, die durch die Oxidation von Eisen entstehen, zu metallischem Kupfer reduziert:
Glaube => Glaubezwei+ + 2e-
Cuzwei+ + 2e- => Cu
Silberoxidreinigung
Silberobjekte werden mit der Zeit schwarz, insbesondere wenn sie mit einer Quelle von Schwefelverbindungen in Kontakt kommen. Der Rost kann entfernt werden, indem das Objekt mit Backpulver und Aluminiumfolie in eine Wanne mit Wasser getaucht wird. Das Bicarbonat liefert die Elektrolyte, die den Elektronentransport zwischen dem Objekt und dem Aluminium erleichtern.
Infolgedessen wird das Kind zu schätzen wissen, dass das Objekt seine schwarzen Flecken verliert und mit seiner charakteristischen silbernen Farbe leuchtet. während die Aluminiumfolie korrodiert, um zu verschwinden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2019). Galvanische Korrosion. Wiederhergestellt von: en.wikipedia.org
- Stephen Lower. (16. Juni 2019). Elektrochemische Korrosion. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Die Offene Universität. (2018). 2.4 Korrosionsprozesse: galvanische Korrosion. Wiederhergestellt von: open.edu
- Technischer Kundendienst Brush Wellman Inc. (s.f.). Ein Leitfaden zur galvanischen Korrosion. Bürsten Sie Wellman Engineered Materials.
- Giorgio Carboni. (1998). Experimente in der Elektrochemie. Wiederhergestellt von: funsci.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.