
Antoines Konstantenformeln, Gleichungen, Beispiele
Das Antoines Konstanten sind drei Parameter, die in einer empirischen Beziehung zwischen Sättigungsdampfdruck und Temperatur für Reinsubstanzen auftreten. Sie hängen von jeder Substanz ab und werden in einem bestimmten Temperaturbereich als konstant angenommen.
Außerhalb dieses Bereichs ändern Antoines Konstanten ihren Wert. Die Konstanten werden durch eine Gleichung in Beziehung gesetzt, die 1888 vom französischen Ingenieur Louis Charles Antoine (1825-1897) erstellt wurde..
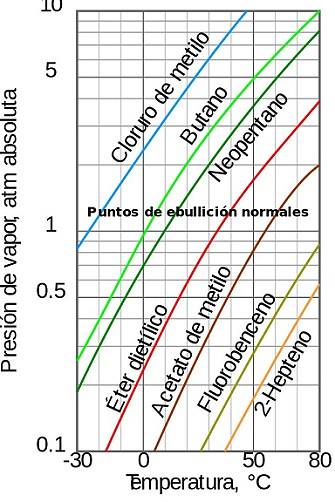
Artikelverzeichnis
- 1 Formeln und Gleichungen
- 2 Sättigungsdampf
- 3 Wie werden Antoines Konstanten berechnet??
- 4 Beispiele
- 4.1 Beispiel 1
- 4.2 Beispiel 2
- 4.3 Lösung
- 5 Referenzen
Formeln und Gleichungen
Die gebräuchlichste Art, die Antoine-Funktion auszudrücken, ist:
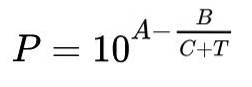
In dieser Formel stellt P den Sättigungsdampfdruck dar, ausgedrückt in Millimetern Quecksilber (mmHg), T ist die Temperatur, die die unabhängige Variable war und in ℃ ausgedrückt wird.
A, B und C sind die Konstanten oder Parameter der Antoine-Formel.
Die Bedeutung dieser Formel, die zwar empirisch ist, aber einen einfachen analytischen Ausdruck liefert, der leicht in thermodynamischen Berechnungen verwendet werden kann..
Antoines Formel ist nicht eindeutig, es gibt genauere Ausdrücke, die Erweiterungen dieser Formel sind, aber mit dem Nachteil, dass sie sechs oder mehr Parameter haben und ihr mathematischer Ausdruck komplexer ist, was ihre Verwendung in thermodynamischen Berechnungen unpraktisch macht..
Sättigungsdampf
Da die Antoine-Formel den Sättigungsdampfdruck misst, muss erklärt werden, woraus er besteht.
Eine Flüssigkeit wird in eine Glasampulle oder einen anderen Behälter gegeben. Die gesamte Luft wird aus der Blase entfernt. Die Baugruppe wird in ein Thermalbad gestellt, bis das Gleichgewicht erreicht ist..
Am Anfang ist alles flüssig, aber weil es ein Vakuum gibt, verlassen die schnelleren Moleküle die Flüssigkeit und bilden ein Gas mit der gleichen Substanz wie die Flüssigkeit..
Der obige Prozess ist der Verdunstung und wenn es passiert, steigt der Dampfdruck an.
Einige der Dampfmoleküle verlieren Energie und treten wieder in die flüssige Phase der Substanz ein. Dies ist der Prozess von Kondensation.
Dann treten zwei Prozesse gleichzeitig auf, Verdampfung und Kondensation. Wenn eine gleiche Anzahl von Molekülen aus der Flüssigkeit austritt, in die sie eingebaut sind, a dynamisches Gleichgewicht und in diesem Moment tritt der maximale Dampfdruck auf, der als Sättigungsdruck bekannt ist.
Es ist dieser Dampfsättigungsdruck, den die Formel von Antoine für jede Substanz und jede Temperatur vorhersagt..
In einigen Feststoffen tritt ein ähnliches Phänomen auf, wenn direkt von der festen Phase in die gasförmige Phase übergegangen wird, ohne die flüssige Phase zu durchlaufen. In diesen Fällen kann auch ein Sättigungsdampfdruck gemessen werden.
Es ist nicht einfach, ein theoretisches Modell zu erstellen, das von ersten Prinzipien ausgeht, da Änderungen der molekularen kinetischen Energie, die translatorisch, rotatorisch und vibrierend sein können, mit der inneren Energie der molekularen Bindung verbunden sind. Aus diesem Grund werden in der Praxis empirische Formeln verwendet.
Wie werden Antoines Konstanten berechnet??
Es gibt keine theoretische Methode, um Antoines Konstanten zu erhalten, da es sich um eine empirische Beziehung handelt.
Sie werden aus den experimentellen Daten jeder Substanz erhalten und die drei Parameter A, B und C so eingestellt, dass sie die quadratische Differenz (Methode der kleinsten Quadrate) der Vorhersage mit den experimentellen Daten minimieren..
Für den Endbenutzer, der in der Regel Chemieingenieure sind, gibt es in den Chemiehandbüchern Tabellen, in denen diese Konstanten für jeden Stoff angegeben sind und die maximalen und minimalen Temperaturbereiche angeben, in denen sie anwendbar sind..
Es gibt auch Online-Dienste, die die Werte der Konstanten A, B und C angeben, wie dies bei den Onlineservices der DDBST GmbH der Fall ist.
Es kann mehr als einen gültigen Temperaturbereich für denselben Stoff geben. Dann wird abhängig vom Arbeitsbereich die eine oder andere Gruppe von Konstanten ausgewählt.
Schwierigkeiten können auftreten, wenn der Arbeitstemperaturbereich zwischen zwei Gültigkeitsbereichen der Konstanten liegt, da die Druckvorhersagen der Formel in der Grenzzone nicht übereinstimmen.
Beispiele
Beispiel 1
Finden Sie den Dampfdruck von Wasser bei 25 ℃.
Lösung
Wir konsultieren die Tabellen, um die Konstanten von Antoine zu bestimmen.
Es gibt zwei Bereiche für Wasser:
Zwischen 1 ℃ und 100 ℃ und zwischen 99 ℃ bis 374 ℃.
Da wir an 25 ℃ interessiert sind, nehmen wir den ersten Bereich, in dem der Wert der Antoine-Konstanten ist:
A = 8,07131
B = 1730,63
C = 233,426
P = 10 ^ (8.07131 - 1730.63 / (25 + 233.426))
Berechnung des Exponenten
Berechnen wir zunächst den Exponenten: 1.374499
P = 10 ^ 1,374499 = 23,686 mmHg = 0,031166 atm
Ergebnisanalyse
Diese Ergebnisse werden folgendermaßen interpretiert:
Angenommen, reines Wasser wird in einen luftdichten Behälter gegeben, aus dem die Luft mittels einer Vakuumpumpe entfernt wurde..
Der Behälter mit dem Wasser wird in ein Thermalbad mit einer Temperatur von 25 ° C gestellt, bis er ein thermisches Gleichgewicht erreicht..
Das Wasser im hermetischen Behälter verdampft teilweise, bis es den Sättigungsdampfdruck erreicht, der nichts anderes als der Druck ist, bei dem das dynamische Gleichgewicht zwischen der flüssigen Phase des Wassers und der Dampfphase hergestellt wird..
Dieser Druck betrug in diesem Fall 0,031166 atm bei 25 ° C..
Beispiel 2
Finden Sie den Dampfdruck von Wasser bei 100 ℃.
Lösung
Wir konsultieren die Tabellen, um die Konstanten von Antoine zu bestimmen. Es gibt zwei Bereiche für Wasser:
Zwischen 1 ℃ und 100 ℃ und zwischen 99 ℃ bis 374 ℃.
In diesem Fall liegt die interessierende Temperatur in den beiden Bereichen.
Wir verwenden den ersten der Bereiche [1 ℃, 100 ℃]
A = 8,07131
B = 1730,63
C = 233,426
P = 10 ^ (8,07131 - 1730,63 / (100 + 233,426))
Berechnung des Exponenten
Berechnen wir zunächst den Exponenten: 2.8808
P = 10 ^ 1,374499 = 760,09 mmHg = 10001 atm
Als nächstes verwenden wir den zweiten der Bereiche [99 ℃, 374 ℃]
In diesem Fall sind die Konstanten
A = 8,14019
B = 1810,94
C = 244,485
P = 10 ^ (8,14019 - 1810,94 / (100 + 244,485))
Berechnen wir zunächst den Exponenten: 2.88324
P = 10 ^ 2,88324 = 764,2602 mmHg = 1,0056 atm
Es gibt einen prozentualen Unterschied zwischen den beiden Ergebnissen von 0,55%.
Verweise
- Anwendung der Gesetze von Raoult und Dalton und der Antoine-Gleichung. Wiederhergestellt von: misapuntesyantación.wordpress.com
- Antoines Formel-Online-Rechner. Wiederhergestellt von: ddbonline.ddbst.de/AntoineCalculation/AntoineCalculationCGI.exe
- Gecousb. Thermodynamik und Dampftabellen / Antoines Konstanten. Wiederhergestellt von: gecousb.com.ve
- Thermische Eigenschaften von Materie. Wiederhergestellt von: webserver.dmt.upm.es
- Gieren und Yang. Antoine-Konstantentabellen für über 700 organische Verbindungen. Wiederhergestellt von: user.eng.umd.edu
- Wikipedia. Antoines Gleichung. Von wikipedia.com wiederhergestellt
- Wikipedia. Clausius-Clapeyron-Gleichung. Von wikipedia.com wiederhergestellt
- Wisniak J. Historische Entwicklung der Dampfdruckgleichung von Dalton zu Antoine. Wiederhergestellt von: link.springer.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.