
Chemische Konzentration Expression, Einheiten, Molalität

Das chemische Konzentration ist das numerische Maß für die relative Menge an gelöstem Stoff in einer Lösung. Dieses Maß drückt ein Verhältnis des gelösten Stoffes zu einer Menge oder einem Volumen des Lösungsmittels oder der Lösung in Konzentrationseinheiten aus. Der Begriff "Konzentration" bezieht sich auf die Menge des vorhandenen gelösten Stoffes: Eine Lösung wird umso konzentrierter, je mehr gelöster Stoff sie enthält.
Diese Einheiten können physikalisch sein, wenn die Massen- und / oder Volumengrößen der Lösung oder der chemischen Komponenten berücksichtigt werden, wenn die Konzentration des gelösten Stoffs in Mol oder Äquivalenten ausgedrückt wird, wobei die Avogadro-Zahl als Referenz dient..

Durch Verwendung von Molekular- oder Atomgewichten und der Avogadro-Zahl ist es daher möglich, physikalische Einheiten in chemische Einheiten umzuwandeln, wenn die Konzentration eines bestimmten gelösten Stoffes ausgedrückt wird. Daher können alle Einheiten für dieselbe Lösung umgerechnet werden.
Artikelverzeichnis
- 1 Verdünnte und konzentrierte Lösungen
- 2 Möglichkeiten, Konzentration auszudrücken
- 2.1 Qualitative Beschreibung
- 2.2 Einstufung nach Löslichkeit
- 2.3 Quantitative Notation
- 3 Konzentrationseinheiten
- 3.1 Relative Konzentrationseinheiten
- 3.2 Einheiten der verdünnten Konzentration
- 3.3 Konzentrationseinheiten als Funktion der Mol
- 3.4 Formalität und Normalität
- 4 Molarität
- 4.1 Übung 1
- 4.2 Übung 2
- 5 Normalität
- 5.1 Berechnung
- 5.2 Übung 1
- 6 Molalität
- 6.1 Übung 1
- 7 Wichtige Hinweise und Empfehlungen zur chemischen Konzentration
- 7.1 Das Volumen der Lösung ist immer größer als das des Lösungsmittels
- 7.2 Nutzen der Molarität
- 7.3 Formeln werden nicht gespeichert, Einheiten oder Definitionen jedoch
- 8 Referenzen
Verdünnte und konzentrierte Lösungen
Wie können Sie feststellen, ob eine Konzentration sehr verdünnt oder konzentriert ist? Auf den ersten Blick durch die Manifestation einer seiner organoleptischen oder chemischen Eigenschaften; das heißt, diejenigen, die die Sinne wahrnehmen oder die gemessen werden können.
Das obige Bild zeigt eine Verdünnung einer Konzentration von Kaliumdichromat (K.zweiCrzweiODER7), die eine orange Farbe aufweist. Von links nach rechts können Sie sehen, wie die Farbe ihre Intensität verringert, wenn die Konzentration verdünnt wird, wobei mehr Lösungsmittel hinzugefügt wird.
Diese Verdünnung ermöglicht es, auf diese Weise eine verdünnte Konzentration aus einer konzentrierten zu erhalten. Die Farbe (und andere "verborgene" Eigenschaften in ihrem orangefarbenen Kern) ändert sich auf die gleiche Weise wie ihre Konzentration, entweder mit physikalischen oder chemischen Einheiten..
Aber was sind die chemischen Konzentrationseinheiten? Darunter befindet sich die Molarität oder Molkonzentration einer Lösung, die die Mol gelösten Stoffs mit dem Gesamtvolumen der Lösung in Litern in Beziehung setzt.
Es gibt auch Molalität oder auch Molkonzentration genannt, die sich auf die Mol gelösten Stoffs bezieht, aber in einer standardisierten Menge des Lösungsmittels oder Lösungsmittels enthalten sind, die genau ein Kilogramm beträgt.
Dieses Lösungsmittel kann rein sein oder wenn die Lösung mehr als ein Lösungsmittel enthält, beträgt die Molalität die Mol gelösten Stoffs pro Kilogramm des Lösungsmittelgemisches..
Und die dritte Einheit der chemischen Konzentration ist die Normalität oder normale Konzentration einer Lösung, die die Anzahl der chemischen Äquivalente des gelösten Stoffes pro Liter der Lösung ausdrückt.
Die Einheit, in der die Normalität ausgedrückt wird, ist in Äquivalenten pro Liter (Gl. / L) angegeben, und in der Medizin wird die Elektrolytkonzentration im Humanserum in Milliäquivalenten pro Liter (mÄq / L) ausgedrückt..
Möglichkeiten, Konzentration auszudrücken

Die Konzentration einer Lösung kann auf drei Arten angegeben werden, obwohl sie selbst eine Vielzahl von Begriffen und Einheiten aufweist, die verwendet werden können, um das Maß für diesen Wert auszudrücken: qualitative Beschreibung, quantitative Notation und Klassifizierung in Bezug auf Löslichkeit.
Abhängig von der Sprache und dem Kontext, in dem Sie arbeiten, wird eine der drei Möglichkeiten gewählt, um die Konzentration einer Mischung auszudrücken.
Qualitative Beschreibung
Die qualitative Beschreibung der Konzentration eines Gemisches wird hauptsächlich in informeller und nichttechnischer Sprache verwendet und in Form von Adjektiven ausgedrückt, die verallgemeinert den Konzentrationsgrad einer Lösung angeben.
Auf diese Weise ist das Mindestkonzentrationsniveau gemäß der qualitativen Beschreibung das einer "verdünnten" Lösung und das Maximum das von "konzentriert"..
Wir sprechen von verdünnten Lösungen, wenn eine Lösung einen sehr geringen Anteil an gelöstem Stoff als Funktion des Gesamtvolumens der Lösung aufweist. Wenn Sie eine Lösung verdünnen möchten, müssen Sie mehr Lösungsmittel hinzufügen oder einen Weg finden, um den gelösten Stoff zu reduzieren.
Wir sprechen jetzt von konzentrierten Lösungen, wenn sie einen hohen Anteil an gelöstem Stoff als Funktion des Gesamtvolumens der Lösung aufweisen. Um eine Lösung zu konzentrieren, müssen Sie mehr gelösten Stoff hinzufügen oder die Menge des Lösungsmittels reduzieren.
In diesem Sinne wird diese Klassifizierung als qualitative Beschreibung bezeichnet, nicht nur, weil ihr mathematische Messungen fehlen, sondern auch wegen ihrer empirischen Qualität (sie kann visuellen Merkmalen, Gerüchen und Geschmäcken zugeordnet werden, ohne dass wissenschaftliche Tests erforderlich sind)..
Einstufung nach Löslichkeit
Die Löslichkeit einer Konzentration gibt die maximale Kapazität des gelösten Stoffes an, die eine Lösung in Abhängigkeit von Bedingungen wie Temperatur, Druck und den gelösten oder suspendierten Substanzen aufweist..
Lösungen können entsprechend ihrem Gehalt an gelöstem gelösten Stoff zum Zeitpunkt der Messung in drei Typen eingeteilt werden: ungesättigte, gesättigte und übersättigte Lösungen.
- Ungesättigte Lösungen sind solche, die weniger gelösten Stoff enthalten, als sich die Lösung auflösen kann. In diesem Fall hat die Lösung ihre maximale Konzentration nicht erreicht.
- Gesättigte Lösungen sind solche, bei denen sich bei einer bestimmten Temperatur die maximal mögliche Menge an gelöstem Stoff im Lösungsmittel gelöst hat. In diesem Fall besteht ein Gleichgewicht zwischen beiden Substanzen und die Lösung kann keinen gelösten Stoff mehr aufnehmen (da sie ausfällt)..
- Übersättigte Lösungen haben mehr gelösten Stoff, als die Lösung unter Gleichgewichtsbedingungen akzeptieren würde. Dies wird durch Erhitzen einer gesättigten Lösung erreicht, wobei mehr gelöster Stoff als normal hinzugefügt wird. Sobald es kalt ist, fällt es den gelösten Stoff nicht automatisch aus, aber jede Störung kann diesen Effekt aufgrund seiner Instabilität verursachen..
Quantitative Notation
Bei der Untersuchung einer Lösung für den technischen oder wissenschaftlichen Bereich ist eine in Einheiten gemessene und ausgedrückte Genauigkeit erforderlich, die die Konzentration anhand ihrer genauen Werte für Masse und / oder Volumen beschreibt..
Aus diesem Grund gibt es eine Reihe von Einheiten, mit denen die Konzentration einer Lösung in ihrer quantitativen Notation ausgedrückt wird. Diese sind in physikalische und chemische unterteilt und haben wiederum ihre eigenen Unterteilungen.
Die Einheiten der physikalischen Konzentrationen sind diejenigen der "relativen Konzentration", die in Prozent ausgedrückt werden. Es gibt drei Möglichkeiten, prozentuale Konzentrationen auszudrücken: Massenprozentsätze, Volumenprozentsätze und Massenvolumenprozentsätze..
Stattdessen basieren Einheiten chemischer Konzentrationen auf Molmengen, Grammäquivalenten, ppm und anderen Eigenschaften des gelösten Stoffes in Bezug auf die Lösung..
Diese Einheiten sind aufgrund ihrer hohen Präzision bei der Messung von Konzentrationen am gebräuchlichsten. Aus diesem Grund sind sie normalerweise diejenigen, die Sie für die Arbeit mit chemischen Lösungen kennen möchten..
Konzentrationseinheiten
Wie in den vorherigen Abschnitten beschrieben, müssen bei der quantitativen Charakterisierung der Konzentration einer Lösung die Berechnungen von den vorhandenen Einheiten für diesen Zweck bestimmt werden..
Ebenso werden die Konzentrationseinheiten in diejenigen der relativen Konzentration, diejenigen der verdünnten Konzentrationen, diejenigen, die auf Molen basieren, und andere zusätzliche Einheiten unterteilt..
Relative Konzentrationseinheiten
Relative Konzentrationen sind die in Prozent ausgedrückten, wie im vorherigen Abschnitt angegeben. Diese Einheiten sind in Masse-Masse-Prozent, Volumen-Volumen-Prozent und Massen-Volumen-Prozent unterteilt und werden wie folgt berechnet:
- % Masse = Masse des gelösten Stoffes (g) / Masse der Gesamtlösung (g) x 100
- % Volumen = Volumen des gelösten Stoffes (ml) / Volumen der Gesamtlösung (ml) x 100
- % Masse / Volumen = Masse des gelösten Stoffes (g) / Volumen der Gesamtlösung (ml) x 100
In diesem Fall muss zur Berechnung der Masse oder des Volumens der Gesamtlösung die Masse oder das Volumen des gelösten Stoffes mit der des Lösungsmittels addiert werden..
Einheiten mit verdünnter Konzentration
Die verdünnten Konzentrationseinheiten sind diejenigen, die verwendet werden, um jene sehr kleinen Konzentrationen auszudrücken, die in Form von Spuren in einer verdünnten Lösung gefunden werden; Die häufigste Verwendung dieser Einheiten besteht darin, Spuren eines in einem anderen gelösten Gases zu finden, z. B. Mittel, die die Luft verschmutzen.
Diese Einheiten werden in Form von Teilen pro Million (ppm), Teilen pro Milliarde (ppb) und Teilen pro Billion (ppt) angegeben und wie folgt ausgedrückt:
- ppm = 1 mg gelöster Stoff / 1 l Lösung
- ppb = 1 μg gelöster Stoff / 1 l Lösung
- ppt = 1 ng gelöster Stoff / 1 l Lösung
In diesen Ausdrücken entspricht mg Milligramm (0,001 g), μg entspricht Mikrogramm (0,000001 g) und ng entspricht Nanogramm (0,000000001 g). Diese Einheiten können auch als Funktion von Volumen / Volumen ausgedrückt werden.
Konzentrationseinheiten als Funktion der Mol
Die auf Mol basierenden Konzentrationseinheiten sind die der Molenfraktion, des Molprozentsatzes, der Molarität und der Molalität (die beiden letzteren werden am Ende des Artikels besser beschrieben)..
Der Molenbruch einer Substanz ist der Anteil aller ihrer Bestandteile (oder Atome) als Funktion der Gesamtmoleküle oder Atome. Es wird wie folgt berechnet:
X.ZU = Molzahl der Substanz A / Gesamtzahl der Mol in Lösung
Dieser Vorgang wird für die anderen Substanzen in Lösung wiederholt, wobei berücksichtigt wird, dass die Summe von X.ZU + X.B. + X.C. ... muss gleich eins sein.
Der Molprozentsatz wird ähnlich wie bei X berechnetZU, nur in Prozent:
Molprozent von A = X.ZU x 100%
Im letzten Abschnitt werden Molarität und Molalität im Detail erörtert..
Formalität und Normalität
Schließlich gibt es zwei Konzentrationseinheiten, die derzeit nicht verwendet werden: Formalität und Normalität..
Die Formalität einer Lösung gibt die Anzahl der Gewichtsformel-Gramm pro Liter Gesamtlösung an. Es wird ausgedrückt als:
F = Nr. P.F.G / L-Lösung
In diesem Ausdruck ist P.F.G gleich dem Gewicht jedes Atoms der Substanz, ausgedrückt in Gramm.
Stattdessen repräsentiert Normalität die Anzahl der gelösten Äquivalente geteilt durch Liter Lösung, wie unten ausgedrückt:
N = äquivalente Gramm gelöster Stoff / l Lösung
In diesem Ausdruck können die äquivalenten Gramm gelösten Stoffes durch die Anzahl der Mol H berechnet werden+, Oh- oder andere Methoden, abhängig von der Art des Moleküls.
Molarität
Die Molarität oder molare Konzentration eines gelösten Stoffes ist die Einheit der chemischen Konzentration, die die Mol des gelösten Stoffes (n) ausdrückt oder in Beziehung setzt, die in einem (1) Liter (L) der Lösung enthalten sind.
Die Molarität wird durch den Großbuchstaben M bezeichnet, und um die Mol des gelösten Stoffes (n) zu bestimmen, werden die Gramm des gelösten Stoffes (g) durch das Molekulargewicht (MW) des gelösten Stoffes geteilt..
Ebenso wird das Molekulargewicht MW des gelösten Stoffes aus der Summe der Atomgewichte (PA) oder der Atommasse der chemischen Elemente unter Berücksichtigung des Anteils erhalten, in dem sie sich verbinden, um den gelösten Stoff zu bilden. Somit haben verschiedene gelöste Stoffe ihre eigene PM (obwohl dies nicht immer der Fall ist).
Diese Definitionen sind in den folgenden Formeln zusammengefasst, mit denen die entsprechenden Berechnungen durchgeführt werden:
Molarität: M = n (Mol gelöster Stoff) / V (Liter Lösung)
Molzahl: n = g gelöster Stoff / MW gelöster Stoff
Übung 1
Berechnen Sie die Molarität einer Lösung, die mit 45 g Ca (OH) hergestellt wurde.zwei gelöst in 250 ml Wasser.
Als erstes muss das Molekulargewicht von Ca (OH) berechnet werden.zwei (Kalziumhydroxid). Die Verbindung besteht nach ihrer chemischen Formel aus einem Calciumkation und zwei Hydroxylanionen. Hier ist das Gewicht eines Elektrons, das kleiner oder zusätzlich zur Spezies ist, vernachlässigbar, so dass die Atomgewichte genommen werden:
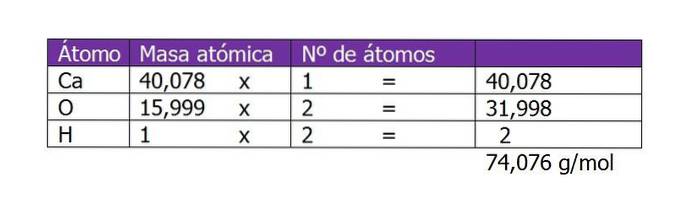
Die Anzahl der Mol des gelösten Stoffes beträgt dann:
n = 45 g / (74 g / mol)
n = 0,61 Mol Ca (OH)zwei
Es werden 0,61 Mol des gelösten Stoffes erhalten, es ist jedoch wichtig zu beachten, dass diese Mol in 250 ml Lösung gelöst liegen. Da die Definition von Molarität Mol in a ist Liter oder 1000 ml, dann muss eine einfache Dreierregel aufgestellt werden, um die Mol zu berechnen, die in 1000 ml der Lösung enthalten sind
Wenn in 250 ml Lösung => 0,61 Mol gelöster Stoff vorhanden sind
In 1000 ml Lösung => x Wie viele Mol gibt es??
x = (0,61 Mol) (1000 ml) / 250 ml
X = 2,44 M (mol / l)
Ein anderer Weg
Der andere Weg, um die Mol zu erhalten, um die Formel anzuwenden, erfordert, dass die 250 ml in Liter genommen werden, wobei auch eine Regel von drei angewendet wird:
Wenn 1000 ml => sind 1 Liter
250 ml => x Wie viele Liter sind?
x = (250 ml) (1 l) / 1000 ml
x = 0,25 l
Ersetzen Sie dann in der Molaritätsformel:
M = (0,61 Mol gelöster Stoff) / (0,25 l Lösung)
M = 2,44 mol / l
Übung 2
Was bedeutet es für eine HCl-Lösung, 2,5 M zu sein??
Die HCl-Lösung ist 2,5 Mol, dh ein Liter davon hat 2,5 Mol Salzsäure gelöst..
Normal
Die Normalität oder äquivalente Konzentration ist die Einheit der chemischen Konzentration der Lösungen, die mit dem Großbuchstaben N bezeichnet ist. Diese Konzentrationseinheit gibt die Reaktivität des gelösten Stoffes an und ist gleich der Anzahl der Äquivalente des gelösten Stoffes (Gl.) Zwischen dem Volumen der Lösung, ausgedrückt in Litern.
N = Gl. / L.
Die Anzahl der Äquivalente (Gl.) Entspricht den Gramm gelösten Stoffes geteilt durch das Äquivalentgewicht (PEq)..
Gl. = G gelöster Stoff / PEq
Das Äquivalentgewicht oder auch als Grammäquivalent bekannt, wird berechnet, indem das Molekulargewicht des gelösten Stoffes erhalten und durch einen Äquivalentfaktor dividiert wird, der zum Zwecke der Zusammenfassung in der Gleichung als Delta-Zeta (ΔZ) bezeichnet wird..
PEq = PM / ΔZ
Berechnung
Die Berechnung der Normalität weist eine sehr spezifische Variation des Äquivalentfaktors oder ΔZ auf, die auch von der Art der chemischen Reaktion abhängt, an der der gelöste Stoff oder die reaktive Spezies beteiligt ist. Einige Fälle dieser Variation können unten erwähnt werden:
-Wenn es um eine Säure oder Base geht, ist ΔZ oder der äquivalente Faktor gleich der Anzahl der Wasserstoffionen (H.+) oder Hydroxyl-OH- das hat den gelösten. Zum Beispiel Schwefelsäure (H.zweiSW4) hat zwei Äquivalente, weil es zwei saure Protonen hat.
-Bei Oxidations-Reduktions-Reaktionen entspricht ΔZ je nach Einzelfall der Anzahl der am Oxidations- oder Reduktionsprozess beteiligten Elektronen. Hier kommt das Ausbalancieren chemischer Gleichungen und die Spezifikation der Reaktion ins Spiel..
-Ebenso entspricht dieser äquivalente Faktor oder ΔZ der Anzahl der Ionen, die bei Reaktionen ausfallen, die als Ausfällung klassifiziert sind..
Übung 1
Bestimmen Sie die Normalität von 185 g NazweiSW4 gefunden in 1,3 l Lösung.
Das Molekulargewicht des gelösten Stoffes in dieser Lösung wird zuerst berechnet:
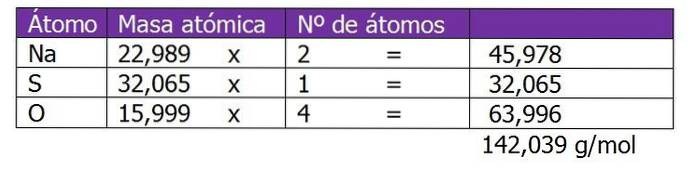
Der zweite Schritt besteht darin, den äquivalenten Faktor oder ΔZ zu berechnen. In diesem Fall wird, da Natriumsulfat ein Salz ist, die Wertigkeit oder Ladung des Kations oder Metalls Na berücksichtigt.+, Dies wird mit 2 multipliziert. Dies ist der Index der chemischen Formel von Salz oder gelöstem Stoff:
N / AzweiSW4 => ∆Z = Valencia Kation x Index
∆Z = 1 x 2
Um das Äquivalentgewicht zu erhalten, wird es in seiner jeweiligen Gleichung eingesetzt:
PEq = (142,039 g / mol) / (2 Äq / mol)
PEq = 71,02 g / Gl
Anschließend können Sie die Anzahl der Äquivalente berechnen und erneut auf eine andere einfache Berechnung zurückgreifen:
Gleichung = (185 g) / (71,02 g / Gleichung)
Anzahl der Äquivalente = 2.605 Gl
Schließlich wird mit allen erforderlichen Daten die Normalität berechnet, indem sie gemäß ihrer Definition ersetzt wird:
N = 2,605 Gl. / 1,3 l
N = 2,0 N.
Molalität
Die Molalität wird durch den Kleinbuchstaben bezeichnet m y ist gleich den Molen gelösten Stoffes, die in einem (1) Kilogramm des Lösungsmittels vorhanden sind. Es ist auch als molare Konzentration bekannt und wird nach folgender Formel berechnet:
m = Mol gelöster Stoff / kg Lösungsmittel
Während die Molarität das Verhältnis der Mol gelösten Stoffs in einem (1) Liter der Lösung festlegt, bezieht sich die Molalität auf die Mol gelösten Stoffs, die in einem (1) Kilogramm Lösungsmittel vorhanden sind.
In den Fällen, in denen die Lösung mit mehr als einem Lösungsmittel hergestellt wird, drückt die Molalität die gleichen Mol gelösten Stoffs pro Kilogramm des Lösungsmittelgemisches aus..
Übung 1
Bestimmen Sie die Molalität einer Lösung, die durch Mischen von 150 g Saccharose (C) hergestellt wurde12H.220elf) mit 300 g Wasser.
Das Molekulargewicht von Saccharose wird zuerst bestimmt, um fortzufahren, um die Mol gelösten Stoffes in dieser Lösung zu berechnen:
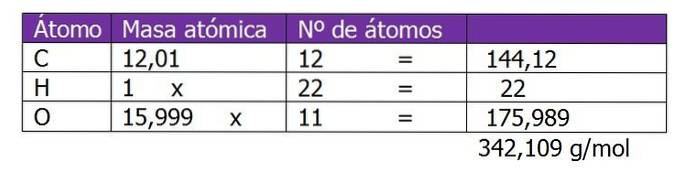
Die Anzahl der Mol Saccharose wird berechnet:
n = (150 g Saccharose) / (342,109 g / mol)
n = 0,438 Mol Saccharose
Dann werden die Gramm Lösungsmittel auf Kilogramm gebracht, um die endgültige Formel anwenden zu können.
Ersetzen Sie dann:
m = 0,438 Mol Saccharose / 0,3 Kilogramm Wasser
m = 1,46 mol C.12H.220elf/ Kg H.zweiODER
Obwohl derzeit eine Debatte über den endgültigen Ausdruck der Molalität geführt wird, kann dieses Ergebnis auch ausgedrückt werden als:
1,26 m C.12H.220elf oder 1,26 molal
Es wird manchmal als vorteilhaft angesehen, die Konzentration der Lösung in Bezug auf die Molalität auszudrücken, da die Massen des gelösten Stoffes und des Lösungsmittels keine leichten Schwankungen oder inapparenten Änderungen aufgrund der Auswirkungen von Temperatur oder Druck erfahren; wie es in Lösungen mit gasförmigem gelöstem Stoff geschieht.
Darüber hinaus wird darauf hingewiesen, dass diese Konzentrationseinheit, die sich auf einen bestimmten gelösten Stoff bezieht, durch das Vorhandensein anderer gelöster Stoffe in der Lösung unverändert bleibt..
Empfehlungen und wichtige Hinweise zur chemischen Konzentration
Das Volumen der Lösung ist immer größer als das des Lösungsmittels
Wenn die Lösungsübungen gelöst sind, entsteht der Fehler, das Volumen einer Lösung so zu interpretieren, als wäre es das des Lösungsmittels. Wenn beispielsweise ein Gramm Schokoladenpulver in einem Liter Wasser gelöst wird, entspricht das Volumen der Lösung nicht dem eines Liters Wasser..
Warum nicht? Weil der gelöste Stoff immer Platz zwischen den Lösungsmittelmolekülen einnimmt. Wenn das Lösungsmittel eine hohe Affinität für den gelösten Stoff aufweist, kann die Volumenänderung nach dem Auflösen vernachlässigbar oder vernachlässigbar sein..
Wenn nicht, und noch mehr, wenn die Menge an gelöstem Stoff groß ist, muss die Volumenänderung berücksichtigt werden. So sein: Vsolvent + Vsolute = Vsolution. Nur in verdünnten Lösungen oder wenn die Mengen an gelöstem Stoff gering sind, gilt Vsolvent = Vsolution.
Dieser Fehler muss insbesondere bei der Arbeit mit flüssigen gelösten Stoffen berücksichtigt werden. Wenn beispielsweise Honig anstelle von Schokoladenpulver in Alkohol gelöst wird, hat das Volumen des zugesetzten Honigs erhebliche Auswirkungen auf das Gesamtvolumen der Lösung..
Daher muss in diesen Fällen das Volumen des gelösten Stoffes zu dem des Lösungsmittels addiert werden..
Nutzen der Molarität
-Die Kenntnis der Molarität einer konzentrierten Lösung ermöglicht die Durchführung von Verdünnungsberechnungen unter Verwendung der einfachen Formel M1V1 = M2V2, wobei M1 der anfänglichen Molarität der Lösung und M2 der Molarität der aus der Lösung M1 herzustellenden Lösung entspricht.
-Wenn man die Molarität einer Lösung kennt, kann ihre Normalität leicht mit der folgenden Formel berechnet werden: Normalität = Anzahl der Äquivalente x M.
Die Formeln werden nicht gespeichert, die Einheiten oder Definitionen jedoch
Manchmal merkt sich das Gedächtnis jedoch nicht alle Gleichungen, die für Konzentrationsberechnungen relevant sind. Dafür ist es sehr nützlich, jedes Konzept sehr klar zu definieren.
Aus der Definition werden die Einheiten mit dem geschrieben Umrechnungsfaktoren um diejenigen auszudrücken, die dem entsprechen, was Sie bestimmen möchten.
Wenn Sie beispielsweise eine Molalität haben und diese in eine normale umwandeln möchten, gehen Sie wie folgt vor:
(mol / kg Lösungsmittel) x (kg / 1000 g) (g Lösungsmittel / ml) (ml Lösungsmittel / ml Lösung) (1000 ml / l) (Gl. / mol)
Beachten Sie, dass (g Lösungsmittel / ml) die Dichte des Lösungsmittels ist. Der Begriff (ml Lösungsmittel / ml Lösung) bezieht sich darauf, wie viel Volumen der Lösung tatsächlich dem Lösungsmittel entspricht. In vielen Übungen ist dieser letzte Term aus praktischen Gründen gleich 1, obwohl er niemals völlig wahr ist..
Verweise
- Einführungschemie- 1st Kanadische Ausgabe. Quantitative Konzentrationseinheiten. Kapitel 11 Lösungen. Entnommen aus: opentextbc.ca
- Wikipedia. (2018). Äquivalente Konzentration. Entnommen aus: en.wikipedia.org
- PharmaFactz. (2018). Was ist Molarität? Entnommen aus: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 101-103, 512, 513.
- Wässrige Lösungen-Molarität. Entnommen aus: chem.ucla.edu
- Quimicas.net (2018). Beispiele für Normalität. Wiederhergestellt von: quimicas.net.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.