
Bleichlorideigenschaften, Struktur, Verwendung
Das Bleichlorid ist ein anorganisches Salz, dessen chemische Formel PbCl istn, wobei n die Oxidationszahl von Blei ist. Wenn Blei also +2 oder +4 ist, ist Salz PbClzwei oder PbCl4, beziehungsweise. Daher gibt es für dieses Metall zwei Arten von Chloriden.
Von den beiden ist das PbClzwei es ist das wichtigste und stabilste; während PbCl4 es ist instabil und weniger nützlich. Das erste ist ionischer Natur, wobei das Kation Pbzwei+ erzeugt elektrostatische Wechselwirkungen mit dem Cl-Anion- ein Kristallgitter bauen; und die zweite ist kovalent, wobei Pb-Cl-Bindungen ein Blei- und Chlortetraeder bilden.

Ein weiterer Unterschied zwischen den beiden Bleichloriden ist das PbClzwei Es ist ein Feststoff aus weißen Kristallen mit der Form von Nadeln (oberes Bild); während PbCl4 Es ist ein gelbliches Öl, das bei -15ºC kristallisieren kann. PbCl-Eingabezwei es ist ästhetischer als PbCl4.
Zusätzlich zu dem, was bereits erwähnt wurde, ist das PbClzwei es kommt in der Natur als Mineral Cotunit vor; während das PbCl4 nein, da es anfällig für Verfall ist. Obwohl aus PbCl4 Sie können das PbO bekommenzwei, von PbClzwei leiten eine endlose Vielfalt von metallorganischen Verbindungen ab.
Artikelverzeichnis
- 1 Eigenschaften
- 1.1-Blei (II) -chlorid
- 1.2 Blei (IV) chlorid
- 2 Struktur
- 2.1-Blei (II) -chlorid
- 2.2 Molekül in der Gasphase
- 3 Nomenklatur
- 4 Verwendungen
- 5 Referenzen
Eigenschaften
Die Eigenschaften von Bleichlorid hängen im wesentlichen von der Oxidationszahl von Blei ab; da sich Chlor nicht ändert, aber die Art und Weise, wie es mit Blei interagiert, tut es. Daher müssen beide Verbindungen getrennt behandelt werden; Blei (II) chlorid einerseits und Blei (IV) chlorid andererseits.
-Blei (II) chlorid
Molmasse
278,10 g / mol.
Aussehen
Weiß gefärbte Kristalle mit Nadelformen.
Dichte
5,85 g / ml.
Schmelzpunkt
501ºC.
Siedepunkt
950ºC.
Wasserlöslichkeit
10,8 g / l bei 20 ° C. Es ist schwer löslich und das Wasser muss erhitzt werden, damit sich eine beträchtliche Menge auflösen kann.
Brechungsindex
2.199.
Blei (IV) chlorid
Molmasse
349,012 g / mol.
Aussehen
Gelblich ölige Flüssigkeit.
Dichte
3,2 g / ml.
Schmelzpunkt
-15ºC.
Siedepunkt
50 ° C. Bei höheren Temperaturen zersetzt es sich unter Freisetzung von gasförmigem Chlor:
PbCl4(s) => PbClzwei(s) + Clzwei(G)
Tatsächlich kann diese Reaktion sehr explosiv werden, so dass PbCl gespeichert wird.4 in Schwefelsäure bei -80ºC.
Struktur
-Blei (II) chlorid
Zunächst wurde erwähnt, dass PbClzwei ist eine ionische Verbindung und besteht daher aus Pb-Ionenzwei+ und Cl- die einen Kristall bilden, in dem ein Pb: Cl-Verhältnis von 1: 2 festgelegt ist; Das heißt, es gibt doppelt so viele Cl-Anionen- welche Kationen Pbzwei+.
Das Ergebnis ist, dass orthorhombische Kristalle gebildet werden, deren Ionen mit einem Modell von Kugeln und Balken wie im Bild unten dargestellt werden können..

Diese Struktur entspricht auch der des Cotunitminerals. Obwohl die Balken verwendet werden, um eine Richtung der Ionenbindung anzuzeigen, sollte sie nicht mit einer kovalenten Bindung (oder zumindest einer rein kovalenten Bindung) verwechselt werden..
In diesen orthorhombischen Kristallen ist das Pbzwei+ (graue Kugeln) hat neun Cl- (grüne Kugeln) umgeben ihn, als wäre er in einem dreieckigen Prisma eingeschlossen. Aufgrund der Komplexität der Struktur und der geringen Ionendichte von Pbzwei+, Es ist für Moleküle schwierig, den Kristall zu solvatisieren. Grund, warum es in kaltem Wasser schlecht löslich ist.
Gasphasenmolekül
Wenn weder der Kristall noch die Flüssigkeit den hohen Temperaturen standhalten können, beginnen die Ionen als PbCl-Moleküle zu verdampfen.zwei diskret; das heißt, mit kovalenten Cl-Pb-Cl-Bindungen und einem Winkel von 98º, als wäre es ein Bumerang. Die Gasphase soll dann aus diesen PbCl-Molekülen bestehenzwei und keine der von Luftströmungen getragenen Ionen.
Blei (IV) chlorid
Inzwischen ist das PbCl4 es ist eine kovalente Verbindung. Warum? Weil das Kation Pb4+ es ist kleiner und hat auch eine höhere Ionenladungsdichte als Pbzwei+, Dies bewirkt eine stärkere Polarisation der Cl-Elektronenwolke-. Das Ergebnis ist, dass anstelle einer Wechselwirkung vom ionischen Typ Pb4+Cl-, Die kovalente Pb-Cl-Bindung wird gebildet.
In Anbetracht dessen ist die Ähnlichkeit zwischen PbCl4 und zum Beispiel das CCl4;; beide treten als einzelne tetraedrische Moleküle auf. Somit wird erklärt, warum dieses Bleichlorid unter normalen Bedingungen ein gelbliches Öl ist; Cl-Atome sind schlecht miteinander verwandt und "rutschen", wenn zwei PbCl-Moleküle4 sie kommen.
Wenn jedoch die Temperatur sinkt und die Moleküle langsamer werden, sind die Wahrscheinlichkeit und die Auswirkungen von augenblicklichen Dipolen (PbCl)4 ist aufgrund seiner Symmetrie unpolar); und dann gefriert das Öl als gelbe hexagonale Kristalle:
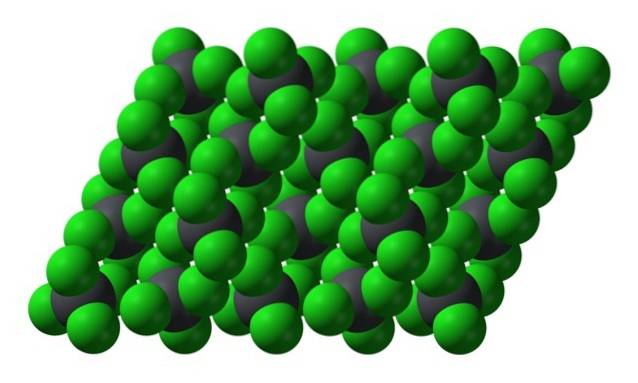
Beachten Sie, dass jede graue Kugel von vier grünen Kugeln umgeben ist. Diese PbCl-Moleküle4 "Zusammengequetscht" bildet einen instabilen Kristall, der einer starken Zersetzung ausgesetzt ist.
Nomenklatur
Die Namen: Blei (II) -chlorid und Blei (IV) -chlorid entsprechen denen, die gemäß der Stock-Nomenklatur vergeben wurden. Da die Oxidationszahl +2 für Blei am niedrigsten und +4 am höchsten ist, können beide Chloride gemäß der traditionellen Nomenklatur als Plumbosechlorid (PbCl) bezeichnet werdenzwei) und Bleichlorid (PbCl4), beziehungsweise.
Und schließlich gibt es die systematische Nomenklatur, die die Anzahl jedes Atoms in der Verbindung hervorhebt. Somit ist das PbClzwei ist Bleidichlorid und PbCl4 Bleitetrachlorid.
Anwendungen
Es ist keine praktische Verwendung für PbCl bekannt4 zusätzlich zur Synthese von PbOzwei. Das PbClzwei Es ist nützlicher und deshalb werden nachfolgend nur einige Verwendungen für dieses spezielle Bleichlorid aufgeführt:
- Aufgrund seiner starken Lumineszenz ist es für fotografische, akustische, optische und Strahlungsdetektorgeräte vorgesehen.
- Da es im Bereich des Infrarotspektrums nicht absorbiert, wird es zur Herstellung von Gläsern verwendet, die diese Art von Strahlung übertragen.
- Es ist Teil des sogenannten goldenen Glases, eines attraktiven Materials mit schillernden bläulichen Färbungen, die für Zierzwecke verwendet werden..
- Weiter zum Thema Kunst, wenn alkalisiert, PbClzweiPb (OH)zwei Es erhält intensive weißliche Töne und wird als weißes Bleipigment verwendet. Von seiner Verwendung wurde jedoch aufgrund seiner hohen Toxizität abgeraten..
- Geschmolzen und gemischt mit Bariumtitanat, BaTiO3, entsteht das keramische Blei Bariumtitanat Ba1 - xPbxOnkel3. Wenn ein Pbzwei+ Geben Sie das BaTiO ein3, ein Bazwei+ es muss den Kristall verlassen, um seinen Einbau zu ermöglichen, und dann soll ein Kationenaustausch stattfinden; daher die Zusammensetzung des Bazwei+ wird als 1-x ausgedrückt.
- Und schließlich aus dem PbClzwei Es werden mehrere metallorganische Bleiverbindungen der allgemeinen Formel R synthetisiert4Pb oder R.3Pb-PbR3.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Blei (II) chlorid. Wiederhergestellt von: en.wikipedia.org
- Chemische Formulierung. (2019). Blei (IV) chlorid. Wiederhergestellt von: formulacionquimica.com
- Clark Jim. (2015). Die Chloride von Kohlenstoff, Silizium und Blei. Wiederhergestellt von: chemguide.co.uk
- Spektrale und optische nichtlineare Untersuchungen an Bleichlorid (PbCl)zwei) Kristalle. [PDF]. Wiederhergestellt von: shodhganga.inflibnet.ac.in
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Bleichlorid. PubChem-Datenbank; CID = 24459. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.