
Chlorgasformel, Wirkungen, Verwendungen und Risiken
Das Chlorgas (Dichlor, zweiatomiges Chlor, molekulares Chlor oder einfach Chlor) ist ein grünlich-gelbes Gas mit einem stechenden und erstickenden Geruch, das bei Raumtemperatur und Atmosphärendruck nicht brennbar ist.
Es ist das Element mit der höchsten Elektronenaffinität und der dritthöchsten Elektronegativität, nur hinter Sauerstoff und Fluor. Es ist extrem reaktiv und ein starkes Oxidationsmittel.
Das hohe Oxidationspotential von elementarem Chlor führte zur Entwicklung kommerzieller Bleichmittel und Desinfektionsmittel sowie eines Reagenzes für viele Prozesse in der chemischen Industrie..
In Form von Chloridionen ist Chlor für alle bekannten Lebensarten notwendig. Elementares Chlor in hohen Konzentrationen ist jedoch für alle lebenden Organismen äußerst gefährlich und giftig, weshalb es im Ersten Weltkrieg als erstes gasförmiges chemisches Kampfmittel eingesetzt wurde..

Es ist giftig beim Einatmen. Langfristiges Einatmen niedriger Konzentrationen oder kurzfristiges Einatmen hoher Chlorgaskonzentrationen haben gesundheitsschädliche Auswirkungen..
Dämpfe sind viel schwerer als Luft und neigen dazu, sich in niedrigen Bereichen abzusetzen. Es brennt nicht, unterstützt aber die Verbrennung. Es ist in Wasser schwer löslich. Kontakt mit nicht eingegrenzten Flüssigkeiten kann zu Erfrierungen bei der Verdunstungskühlung führen.
Wird verwendet, um Wasser zu reinigen, Holzzellstoff zu bleichen und andere Chemikalien herzustellen.
Artikelverzeichnis
- 1 Formel
- 2 2D-Struktur
- 3 Funktionen
- 3.1 Physikalische und chemische Eigenschaften
- 3.2 Reaktivitätswarnungen
- 3.3 Entflammbarkeit
- 3.4 Reaktivität
- 3.5 Toxizität
- 4 Verwendungen
- 5 Klinische Wirkungen
- 6 Sicherheit und Risiken
- 6.1 GHS-Gefahrenklassen
- 6.2 Sicherheitshinweiscodes
- 7 Referenzen
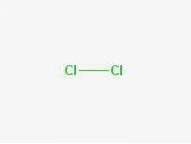
Formel
Formel: Cl-Cl
CAS-Nummer: 7782-50-5
2D-Struktur

Eigenschaften
Physikalische und chemische Eigenschaften

Chlorgas gehört zur reaktiven Gruppe der starken Oxidationsmittel. Diese Verbindungen reagieren oft heftig mit anderen Verbindungen..
Chlorgas gehört auch zur reaktiven Gruppe starker Halogenierungsmittel, die ein oder mehrere Halogenatome auf die Verbindung übertragen, mit der sie reagieren..
Halogenierungsmittel sind im Allgemeinen sauer und reagieren daher teilweise heftig mit Basen.
Viele dieser Verbindungen reagieren auf Wasser und auf Luft. Halogene sind hoch elektronegative und starke Oxidationsmittel.
Reaktivitätswarnungen
Chlorgas ist ein starkes Oxidationsmittel. Reagiert mit Wasser. Wasser löst Chlorgas unter Bildung eines Gemisches aus Salzsäure und Hypochlorsäure.
Entzündbarkeit
Es kann andere brennbare Materialien (Holz, Papier, Öl usw.) entzünden. Das Mischen mit Kraftstoffen kann eine Explosion verursachen. Der Behälter kann bei Kontakt mit Feuer explodieren. Es besteht Explosions- (und Vergiftungs-) Gefahr durch Ansammlung seiner Dämpfe in Innenräumen, Abwasserkanälen oder im Freien..
Wasserstoff- und Chlormischungen (5-95%) können durch die Einwirkung nahezu jeder Energieform (Wärme, Sonnenlicht, Funken usw.) explodieren..
Beim Erhitzen entstehen hochgiftige Dämpfe. In Kombination mit Wasser oder Dampf entstehen giftige und ätzende Salzsäuredämpfe.
Reaktivität
Chlor reagiert explosionsartig mit vielen gängigen Materialien (oder unterstützt deren Verbrennung).
- Chlor entzündet Stahl bei 100 ° C in Gegenwart von Ruß, Oxid, Kohlenstoff oder anderen Katalysatoren.
- Schalten Sie die trockene Stahlwolle bei 50 ° C ein.
- Sulfide bei Raumtemperatur entzünden.
- Zündet (in flüssiger Form) Natur- und Synthesekautschuk.
- Entzündet Trialkylborane und Wolframdioxid.
- Entzündet sich bei Kontakt mit Hydrazin, Hydroxylamin und Calciumnitrid.
- Entzündet oder explodiert mit Arsin, Phosphin, Silan, Diboran, Stibin, rotem Phosphor, weißem Phosphor, Bor, Aktivkohle, Silizium, Arsen.
- Verursacht beim Sprudeln durch kaltes Methanol eine Entzündung und eine sanfte Explosion.
- Explodiert oder entzündet sich, wenn es übermäßig mit Ammoniak gemischt und erhitzt wird.
- Bildet bei Kontakt mit mit Cyanursäure kontaminiertem Biuret-Reagenz explosives Stickstofftrichlorid.
- Bildet mit Aziridin leicht explosive Derivate von N-Chlor.
Chlor (in flüssiger oder gasförmiger Form) reagiert mit:
- Alkohole (Explosion)
- Geschmolzenes Aluminium (Explosion)
- Silane (Explosion)
- Brompentafluorid
- Schwefelkohlenstoff (eisenkatalysierte Explosion)
- Chlor-2-propin (überschüssiges Chlor verursacht eine Explosion)
- Dibutylphthalat (Explosion bei 118 ° C)
- Diethylether (beleuchtet)
- Diethylzink (beleuchtet)
- Glycerin (Explosion bei 70-80 ° C)
- Methan auf gelbem Quecksilberoxid (Explosion)
- Acetylen (Explosion durch Sonnenlicht oder Erhitzen)
- Ethylen auf Quecksilber, Quecksilber (I) oxid oder Silber (I) oxid (Explosion durch Hitze oder Licht)
- Benzin (exotherme Reaktion und anschließende Detonation)
- Naphtha-Natriumhydroxid-Gemisch (heftige Explosion)
- Zinkchlorid (exotherme Reaktion)
- Wachs (Explosion)
- Wasserstoff (Explosion durch Licht ausgelöst)
- Eisencarbid
- Uran und Zirkonium
- Natrium-, Kalium- und Kupferhydride
- Zinn
- Aluminiumpulver
- Vanadiumpulver
- Aluminiumfolie
- Lametta
- Kupferfolie
- Calciumpulver
- Eisendraht
- Manganpulver
- Kalium
- Antimonpulver
- Wismut
- Germanium
- Magnesium
- Natrium
- Zink
Toxizität
Chlorgas ist giftig und kann beim Einatmen tödlich sein. Kontakt kann Haut- und Augenverbrennungen sowie Bronchitis oder chronische Lungenerkrankungen verursachen..

Anwendungen
Ungefähr 15.000 Chlorverbindungen werden heute kommerziell verwendet. Natriumchlorid ist bei weitem die häufigste Chlorverbindung und die Hauptquelle für Chlor und Salzsäure in der riesigen chemischen Chemieindustrie..
Von dem gesamten produzierten elementaren Chlor werden ungefähr 63% für die Herstellung organischer Verbindungen, 18% für die Herstellung anorganischer Chlorverbindungen und die restlichen 19% des produzierten Chlors für Bleichmittel und Desinfektionsprodukte verwendet..

Zu den hinsichtlich des Produktionsvolumens bedeutendsten organischen Verbindungen zählen unter anderem 1,2-Dichlorethan und Vinylchlorid (Zwischenprodukte bei der Herstellung von PVC), Methylchlorid, Methylenchlorid, Chloroform und Vinylidenchlorid.
Die wichtigsten anorganischen Verbindungen umfassen HCl, Cl 2 O, HOCl, NaClO 3, AlCl 3, SiCl 4, SnCl 4, PCl 3, PCl 5, POCl 3, AsCl 3, SbCl 3, SbCl 5, BiCl 3, S2Cl 2, SCl 2, SOCI 2, ClF 3, ICl, ICl 3, MoCl 3, TiCl , ZnCl2 und viele mehr.
Chlorgas wird in industriellen Bleichvorgängen, in der Abwasserbehandlung, bei der Herstellung von Tabletten zur Chlorierung von Schwimmbädern oder in der chemischen Kriegsführung eingesetzt.
Chlorgas (bekannt als Bertholit) wurde erstmals im Ersten Weltkrieg von Deutschland als Waffe eingesetzt.
Nach seiner ersten Verwendung verwendeten beide Konfliktparteien Chlor als chemische Waffe, aber es wurde bald durch Phosgen und Senfgas ersetzt, die tödlicher sind..
Chlorgas wurde auch während des Irak-Krieges in der Provinz Anbar im Jahr 2007 verwendet.
Klinische Wirkungen
Chlorgas ist eine der häufigsten berufsbedingten und umweltbedingten Expositionen gegenüber Einzelinhalationsreizstoffen. Jüngste Studien haben berichtet, dass die Mischung von Bleichmittel (Bleichmittel, das hauptsächlich auf der Basis von Natriumhypochlorit hergestellt wird) mit anderen Reinigungsprodukten die häufigste Ursache (21% der Fälle) für eine einmalige Inhalationsexposition ist, die in Giftinformationszentren aus den USA gemeldet wurde.
Die hauptsächlichen toxischen Wirkungen sind eher auf lokale Gewebeschäden als auf systemische Absorption zurückzuführen. Es wird angenommen, dass eine Zellverletzung aus der Oxidation funktioneller Gruppen an zellulären Komponenten resultiert; auf Reaktionen mit Wasser in Geweben unter Bildung von Hypochlorsäure und Salzsäure; und die Erzeugung von freien Sauerstoffradikalen (obwohl diese Idee jetzt umstritten ist).
Bei leichter bis mittelschwerer Vergiftung gibt es: Husten, Atemnot, Brustschmerzen, Brennen im Hals und im retrosternalen Bereich, Übelkeit oder Erbrechen, Augen- und Nasenreizung, Erstickung, Muskelschwäche, Schwindel, Bauchbeschwerden und Kopfschmerzen.
Bei schwerer Vergiftung gibt es: Ödeme der oberen Atemwege, Laryngospasmus, schweres Lungenödem, Lungenentzündung, anhaltende Hypoxämie, Atemversagen, akute Lungenverletzung und metabolische Azidose.
Chronische Exposition gegenüber Chlorgas ist eine der häufigsten Ursachen für Berufsasthma. Es kann Dyspnoe, Herzklopfen, Brustschmerzen, reaktives Syndrom der Funktionsstörung der oberen Atemwege, Erosion des Zahnschmelzes und erhöhte Prävalenz von Virussyndromen verursachen. Chronische Exposition gegenüber 15 ppm verursacht Husten, Hämoptyse, Brustschmerzen und Halsschmerzen.
Dermale Exposition kann zu Hautrötungen, Schmerzen, Reizungen und Verbrennungen führen. Schwere Exposition kann zu Herz-Kreislauf-Kollaps und Atemstillstand führen. In hohen Konzentrationen können Synkope und fast sofortiger Tod auftreten. Chlor (als Hypochlorit) ist bei Versuchstieren teratogen.
Sicherheit und Risiken
Gefahrenhinweise des global harmonisierten Systems zur Einstufung und Kennzeichnung von Chemikalien (GHS).
Das global harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien (GHS) ist ein international vereinbartes System, das von den Vereinten Nationen geschaffen wurde, um die verschiedenen in verschiedenen Ländern verwendeten Klassifizierungs- und Kennzeichnungsstandards durch einheitliche Kriterien auf globaler Ebene zu ersetzen (Nations United, 2015) ).
Die Gefahrenklassen (und das entsprechende GHS-Kapitel), die Klassifizierungs- und Kennzeichnungsstandards sowie die Empfehlungen für Chlorgas lauten wie folgt (Europäische Chemikalienagentur, 2017; Vereinte Nationen, 2015; PubChem, 2017):
GHS-Gefahrenklassen
H270: Kann Feuer verursachen oder verstärken; Oxidationsmittel [Gefahr Oxidierende Gase - Kategorie 1]
H280: Enthält unter Druck stehendes Gas; Kann bei Erwärmung explodieren [Warngase unter Druck - Druckgas, Flüssiggas, gelöstes Gas]
H315: Verursacht Hautreizungen [Warnung Hautkorrosion / -reizung - Kategorie 2]
H319: Verursacht schwere Augenreizungen [Warnung Schwere Augenschäden / Augenreizungen - Kategorie 2A]
H330: Durch Einatmen tödlich [Gefahr Akute Toxizität, Einatmen - Kategorie 1, 2]
H331: Giftig beim Einatmen [Gefahr Akute Toxizität, Einatmen - Kategorie 3]
H335: Kann Reizungen der Atemwege verursachen [Warnung Spezifische Toxizität der Zielorgane, einmalige Exposition; Reizung der Atemwege - Kategorie 3]
H400: Sehr giftig für Wasserlebewesen [Warnung Gefährlich für die aquatische Umwelt, akute Gefahr - Kategorie 1]
H410: Sehr giftig für Wasserorganismen mit lang anhaltender Wirkung [Warnung Gefährlich für die aquatische Umwelt, Langzeitgefahr - Kategorie 1]
(PubChem, 2017)
Codes für Vorsichtsmaßnahmen
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313 P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 und P501.
Verweise
- Benjah-bmm27 (2007). Dichlor-Gas-3D-vdW [Bild]. Wiederhergestellt von: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [Bild]. Wiederhergestellt von: commons.wikimedia.org.
- ChemIDplus (2017) 3D-Struktur von 7782-50-5 - Chlor [Bild] Wiederhergestellt aus: chem.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datenblatt für reaktive Gruppen. Oxidationsmittel, stark. Silver Spring, MD. EU; Wiederhergestellt von: comeochemicals.noaa.gov.
- Oelen, W. (2005). Chlorgas in einer Flasche [Bild]. Wiederhergestellt von: commons.wikimedia.org.
- Sargent, J. (1918). Vergast [Bild]. Wiederhergestellt von: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [Bild]. Wiederhergestellt von: commons.wikimedia.org.
- Wikipedia (2017). Chlor. Wiederhergestellt von: en.wikipedia.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.