
Säureeigenschaften und Beispiele

Das Säuren Sie sind Verbindungen mit einer hohen Tendenz, Protonen abzugeben oder ein Elektronenpaar aufzunehmen. Es gibt viele Definitionen (Bronsted, Arrhenius, Lewis), die die Eigenschaften von Säuren charakterisieren, und jede von ihnen wird ergänzt, um ein globales Bild dieser Art von Verbindungen zu erstellen..
Aus der obigen Perspektive können alle bekannten Substanzen sauer sein, jedoch werden nur diejenigen als solche betrachtet, die weit über den anderen hervorstechen. Mit anderen Worten: Wenn eine Substanz im Vergleich zu Wasser beispielsweise ein extrem schwacher Protonendonor ist, kann gesagt werden, dass es sich nicht um eine Säure handelt.

Was genau sind in diesem Fall die Säuren und ihre natürlichen Quellen? Ein typisches Beispiel dafür findet sich in vielen Früchten: wie Zitrusfrüchten. Limonaden haben ihren charakteristischen Geschmack aufgrund von Zitronensäure und anderen Bestandteilen.
Die Zunge kann das Vorhandensein von Säuren erkennen, genau wie bei anderen Geschmacksrichtungen. Je nach Säuregehalt dieser Verbindungen wird der Geschmack unerträglicher. Auf diese Weise fungiert die Zunge als organoleptisches Messgerät für die Konzentration von Säuren, insbesondere die Konzentration von Hydroniumionen (H.3ODER+).
Andererseits kommen Säuren nicht nur in Lebensmitteln vor, sondern auch in lebenden Organismen. Ebenso enthalten Böden Substanzen, die sie als sauer charakterisieren können; Dies ist der Fall bei Aluminium und anderen Metallkationen.
Artikelverzeichnis
- 1 Eigenschaften von Säuren
- 1.1 - Physikalische Eigenschaften
- 1.2 - Fähigkeit zur Erzeugung von Protonen
- 1.3 - Sie haben Wasserstoffatome mit geringer Elektronendichte
- 1.4 - Stärke oder Säurekonstante
- 1.5 - Es hat sehr stabile konjugierte Basen
- 1.6 - Sie können positive Ladungen haben
- 1.7 - Ihre Lösungen haben pH-Werte unter 7
- 1.8 - Fähigkeit, Basen zu neutralisieren
- 2 Starke Säuren und schwache Säuren
- 3 Beispiele für Säuren
- 3.1 Halogenwasserstoffe
- 3.2 Oxosäuren
- 3.3 Supersäuren
- 3.4 Organische Säuren
- 4 Referenzen
Eigenschaften von Säuren
Welche Eigenschaften muss eine Verbindung nach bestehenden Definitionen haben, um als sauer zu gelten??
Muss in der Lage sein, H-Ionen zu erzeugen+ und OH- Wenn es sich in Wasser auflöst (Arrhenius), muss es sehr leicht Protonen an andere Spezies abgeben (Bronsted) oder schließlich muss es in der Lage sein, ein Elektronenpaar aufzunehmen, das sich negativ auflädt (Lewis)..
Diese Eigenschaften hängen jedoch eng mit der chemischen Struktur zusammen. Wenn man lernt, es zu analysieren, ist es daher möglich, seine Säurestärke oder einige Verbindungen abzuleiten, welche der beiden am sauersten ist..
- Physikalische Eigenschaften
Säuren haben einen Geschmack, der die Redundanz wert ist, Säure und ihr Geruch verbrennt oft die Nasenlöcher. Sie sind Flüssigkeiten mit einer klebrigen oder öligen Textur und können die Farbe von Lackmuspapier und Methylorange in Rot ändern (Eigenschaften von Säuren und Basen, S.F.).
- Fähigkeit, Protonen zu erzeugen
1923 führten der dänische Chemiker Johannes Nicolaus Brønsted und der englische Chemiker Thomas Martin Lowry die Theorie von Brønsted und Lowry ein, wonach jede Verbindung, die ein Proton auf eine andere Verbindung übertragen kann, eine Säure ist (Encyclopædia Britannica, 1998). Zum Beispiel bei Salzsäure:
HCl → H.+ + Cl-
Die Theorie von Brønsted und Lowry erklärte das saure Verhalten bestimmter Substanzen nicht. 1923 stellte der amerikanische Chemiker Gilbert N. Lewis seine Theorie vor, in der eine Säure als jede Verbindung betrachtet wird, die bei einer chemischen Reaktion ein Elektronenpaar verbinden kann, das nicht in einem anderen Molekül geteilt wird (Encyclopædia Britannica, 1998)..
Auf diese Weise können Ionen wie Cuzwei+, Vertrauenzwei+ und der Glaube3+ Sie haben die Fähigkeit, sich mit Paaren freier Elektronen zu verbinden, beispielsweise aus Wasser, um Protonen auf folgende Weise zu produzieren:
Cuzwei+ + 2HzweiO → Cu (OH)zwei + 2H+
- Sie haben Wasserstoffatome mit geringer Elektronendichte
Für das Methanmolekül ist CH4, Keiner seiner Wasserstoffatome ist elektronisch mangelhaft. Dies liegt daran, dass der Elektronegativitätsunterschied zwischen Kohlenstoff und Wasserstoff sehr gering ist. Wenn jedoch eines der H-Atome durch eines von Fluor ersetzt würde, würde sich das Dipolmoment merklich ändern: H.zweiFC-H..
H. es erfährt eine Verschiebung seiner Elektronenwolke in Richtung des benachbarten Atoms, das an das F gebunden ist, was dasselbe ist, δ + nimmt zu. Wenn ein anderes H durch ein anderes F ersetzt wird, sieht das Molekül wieder wie folgt aus: HFzweiC.-H..
Jetzt ist δ + sogar noch höher, da es sich um zwei hochelektronegative F-Atome handelt, die die Elektronendichte von C und folglich von C subtrahieren H.. Wenn der Substitutionsprozess fortgesetzt würde, würde er schließlich erhalten werden: F.3C.-H..
In diesem letzten Molekül H. weist als Folge der drei benachbarten F-Atome einen deutlichen elektronischen Mangel auf. Dieses δ + bleibt von keiner Spezies unbemerkt, die reich genug an Elektronen ist, um dies zu entfernen H. und damit F.3CH wird negativ geladen:
F.3C.-H. + : N.- (negative Spezies) => F.3C:- + H.N.
Die obige chemische Gleichung kann auch folgendermaßen betrachtet werden: F.3CH spendet ein Proton (H.+, das H. einmal vom Molekül gelöst) a: N; von3CH gewinnt ein Elektronenpaar aus H. als ein anderes Paar wurde dem letzteren gespendet von: N.-.
- Säurestärke oder konstant
Wie viel F.3C:- ist es in der Lösung vorhanden? Oder wie viele Moleküle von F.3CH kann Wasserstoffsäure an N spenden? Um diese Fragen zu beantworten, muss die Konzentration von F bestimmt werden3C:- oder von H.N und unter Verwendung einer mathematischen Gleichung einen numerischen Wert festlegen, der als Säurekonstante Ka bezeichnet wird.
Je mehr Moleküle von F.3C:- oder HN erzeugt werden, desto mehr Säure wird F sein3CH und größer sein Ka. Auf diese Weise hilft Ka quantitativ zu klären, welche Verbindungen saurer sind als andere; und ebenso verwirft es diejenigen als Säuren, deren Ka von einer extrem kleinen Ordnung sind.
Einige Ka können Werte um 10 haben-1 und 10-5, und andere Werte Millionstel kleiner wie 10-fünfzehn und 10-35. Es kann dann gesagt werden, dass letztere mit diesen Säurekonstanten extrem schwache Säuren sind und als solche verworfen werden können..
Welches der folgenden Moleküle hat also das höchste Ka: CH4, CH3F, CHzweiF.zwei oder CHF3? Die Antwort liegt in der fehlenden Elektronendichte δ + in ihren Wasserstoffatomen..
Messungen
Aber was sind die Kriterien für die Standardisierung von Ka-Messungen? Sein Wert kann enorm variieren, je nachdem, welche Art das H erhält+. Wenn zum Beispiel: N eine starke Basis ist, ist Ka groß; aber wenn es im Gegenteil eine sehr schwache Basis ist, wird Ka klein sein.
Ka-Messungen werden mit der häufigsten und schwächsten aller Basen (und Säuren) durchgeführt: Wasser. Abhängig vom Spendengrad von H.+ zu H-MolekülenzweiOder bei 25 ° C und einem Druck von einer Atmosphäre werden die Standardbedingungen festgelegt, um die Säurekonstanten für alle Verbindungen zu bestimmen.
Daraus ergibt sich ein Repertoire von Tabellen mit Säurekonstanten für viele anorganische und organische Verbindungen..
- Es hat sehr stabile konjugierte Basen
Säuren haben stark elektronegative Atome oder Einheiten (aromatische Ringe) in ihren chemischen Strukturen, die Elektronendichten von umgebenden Wasserstoffatomen anziehen, wodurch sie teilweise positiv und reaktiv gegenüber einer Base werden.
Sobald die Protonen spenden, verwandelt sich die Säure in eine konjugierte Base. das heißt, eine negative Spezies, die H akzeptieren kann+ oder spenden Sie ein Paar Elektronen. Im Beispiel des CF-Moleküls3H seine konjugierte Base ist CF.3-::
CF.3- + HN <=> CHF3 + : N.-
Ja CF.3- ist eine sehr stabile konjugierte Base, wird das Gleichgewicht mehr nach links als nach rechts verschoben. Je stabiler es ist, desto reaktiver und saurer ist die Säure..
Woher weißt du, wie stabil sie sind? Es hängt alles davon ab, wie sie mit der neuen negativen Ladung umgehen. Wenn sie es delokalisieren oder die zunehmende Elektronendichte effizient diffundieren können, steht es nicht für die Bindung mit der Base H zur Verfügung..
- Sie können positive Ladungen haben
Nicht alle Säuren haben elektronenarme Wasserstoffatome, aber sie können auch andere Atome aufweisen, die Elektronen mit oder ohne positive Ladung aufnehmen können..
Wie ist das? Zum Beispiel in Bortrifluorid, BF3, Dem B-Atom fehlt ein Valenzoktett, so dass es mit jedem Atom, das ihm ein Elektronenpaar gibt, eine Bindung eingehen kann. Wenn ein Anion F.- In seiner Nähe tritt die folgende chemische Reaktion auf:
BF3 + F.- => BF4-
Andererseits können freie Metallkationen wie Al3+, Znzwei+, N / A+, usw. gelten als sauer, da sie aus ihrer Umgebung Dativbindungen (Koordinationsbindungen) elektronenreicher Spezies akzeptieren können. Sie reagieren auch mit OH-Ionen- als Metallhydroxide auszufällen:
Znzwei+(aq) + 2OH-(ac) => Zn (OH)zwei(s)
Alle diese sind als Lewis-Säuren bekannt, während diejenigen, die Protonen spenden, Brönsted-Säuren sind..
- Ihre Lösungen haben pH-Werte von weniger als 7
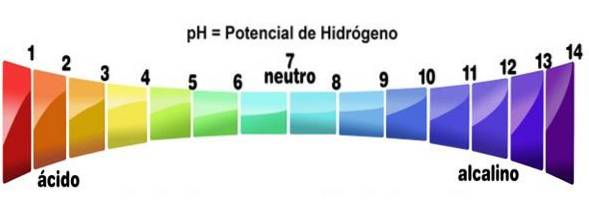
Insbesondere wenn sich eine Säure in einem Lösungsmittel löst (das sie nicht nennenswert neutralisiert), erzeugt sie Lösungen mit einem pH-Wert von weniger als 3, obwohl sie unter 7 als sehr schwache Säuren gelten..
Dies kann mithilfe eines Säure-Base-Indikators wie Phenolphthalein, Universalindikator oder Purpurkohlsaft überprüft werden. Diejenigen Verbindungen, die die Farben auf die für einen niedrigen pH-Wert angegebenen ändern, werden als Säuren behandelt. Dies ist einer der einfachsten Tests, um das Vorhandensein von ihnen festzustellen..
Das Gleiche kann beispielsweise für verschiedene Bodenproben aus verschiedenen Teilen der Welt durchgeführt werden, um deren pH-Werte zusammen mit anderen Variablen zu bestimmen und zu charakterisieren..
Und schließlich haben alle Säuren saure Aromen, solange sie nicht so konzentriert sind, dass sie das Gewebe der Zunge irreversibel verbrennen..
- Fähigkeit, Basen zu neutralisieren
Arrhenius schlägt in seiner Theorie vor, dass Säuren, indem sie Protonen erzeugen können, mit der Hydroxylgruppe der Basen unter Bildung von Salz und Wasser auf folgende Weise reagieren:
HCl + NaOH → NaCl + H.zweiODER.
Diese Reaktion wird als Neutralisation bezeichnet und ist die Grundlage der als Titration bezeichneten Analysetechnik (Bruce Mahan, 1990)..
Starke Säuren und schwache Säuren
Säuren werden in starke und schwache Säuren eingeteilt. Die Stärke einer Säure ist mit ihrer Gleichgewichtskonstante verbunden, daher werden diese Konstanten im Fall von Säuren als Säurekonstanten Ka bezeichnet.
Daher haben starke Säuren eine große Säurekonstante, so dass sie dazu neigen, vollständig zu dissoziieren. Beispiele für diese Säuren sind Schwefelsäure, Salzsäure und Salpetersäure, deren Säurekonstanten so groß sind, dass sie in Wasser nicht gemessen werden können..
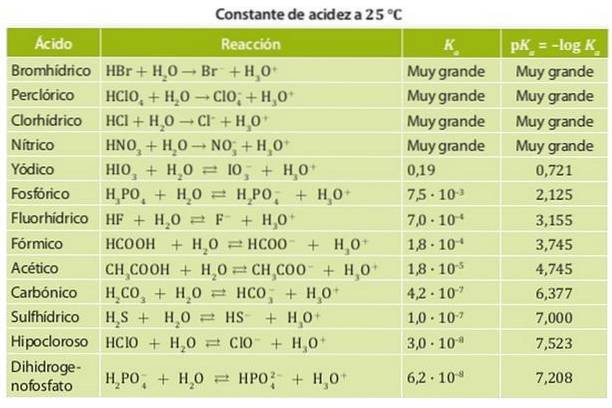
Andererseits ist eine schwache Säure eine Säure, deren Dissoziationskonstante niedrig ist, so dass sie sich im chemischen Gleichgewicht befindet. Beispiele für diese Säuren sind Essigsäure, Milchsäure und salpetrige Säure, deren Säurekonstanten in der Größenordnung von 10 liegen-4. Abbildung 1 zeigt die verschiedenen Säurekonstanten für verschiedene Säuren.
Beispiele für Säuren
Halogenwasserstoffe
Alle Halogenwasserstoffe sind saure Verbindungen, insbesondere wenn sie in Wasser gelöst sind:
-HF (Flusssäure).
-HCl (Salzsäure).
-HBr (Bromwasserstoffsäure).
-HI (Jodsäure).
Oxosäuren
Oxosäuren sind die protonierten Formen von Oxoanionen:
HNO3 (Salpetersäure).
H.zweiSW4 (Schwefelsäure).
H.3PO4 (Phosphorsäure).
HClO4 (Perchlorsäure).
Supersäuren
Supersäuren sind die Mischung aus einer starken Brönsted-Säure und einer starken Lewis-Säure. Einmal gemischt, bilden sie komplexe Strukturen, in denen nach bestimmten Studien das H.+ "Springe" in sie hinein.
Ihre korrosive Kraft ist so, dass sie milliardenfach stärker sind als H.zweiSW4 konzentriert. Sie werden verwendet, um große Moleküle, die in Rohöl vorhanden sind, in kleinere, verzweigte Moleküle mit großem wirtschaftlichem Mehrwert zu zerlegen..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F.
-CF.3SW3H.
Organische Säuren
Organische Säuren zeichnen sich durch eine oder mehrere Carbonsäuregruppen (COOH) aus, darunter:
-Zitronensäure (in vielen Früchten enthalten)
-Apfelsäure (aus grünen Äpfeln)
-Essigsäure (aus handelsüblichem Essig)
-Buttersäure (aus ranziger Butter)
-Weinsäure (aus Weinen)
-Und die Fettsäurefamilie.
Verweise
- Torrens H. Harte und weiche Säuren und Basen. [PDF]. Entnommen aus: depa.fquim.unam.mx
- Helmenstine, Anne Marie, Ph.D. (3. Mai 2018). Namen von 10 gebräuchlichen Säuren. Wiederhergestellt von :oughtco.com
- Chempages Netorials. Säuren und Basen: Molekülstruktur und Verhalten. Entnommen aus: chem.wisc.edu
- Deziel, Chris. (27. April 2018). Allgemeine Eigenschaften von Säuren und Basen. Wissenschaft. Wiederhergestellt von: sciencing.com
- Pittsburgh Supercomputing Center (PSC). (25. Oktober 2000). Wiederhergestellt von: psc.edu.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.