
Sulfanilsäurestruktur, Eigenschaften, Synthese, Verwendung

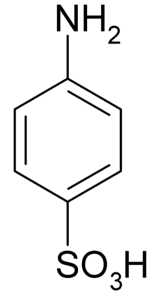
Das Sulfanilsäure ist eine kristalline Verbindung, deren Molekül durch einen Benzolring gebildet wird, zu dem eine basische Gruppe (-NH) gehörtzwei) und eine Säuregruppe (-SO3H). Seine chemische Formel lautet NHzweiC.6H.4SW3H..
Es ist auch als 4-Aminobenzolsulfonsäure bekannt. Es wird durch Sulfonierung von Anilin in para-Position hergestellt. Seine Kristalle sind weiß oder grauweiß. Sein Verhalten ähnelt eher dem eines Salzes als dem einer organischen Verbindung mit NH-Gruppenzwei Bär3H. Daher ist es in den meisten organischen Lösungsmitteln unlöslich.
Eine seiner Hauptanwendungen ist die Synthese von Farbstoffen, da es leicht eine Diazoverbindung bildet, die ein Rohmaterial für diese Anwendung ist..
Sowohl Sulfanilsäure als auch ihre Derivate wurden als antibakterielle Mittel verwendet. Es wird bei der Synthese von mukolytischen Verbindungen verwendet, da diese die Viskosität von Schleim oder hochviskosen biologischen Flüssigkeiten verringern können..
Es wird auch in der Papierindustrie und in Formeln für Gravuren oder Lithografien verwendet. Es ist Teil der Harze, die in Beton- oder Mörtelmischungen verwendet werden, damit diese ihre Fließfähigkeit über einen langen Zeitraum beibehalten können, ohne die endgültige Abbindezeit zu beeinflussen.
Es ist ein xenobiotischer Metabolit, das heißt, es wird nicht auf natürliche Weise von Lebewesen produziert. Es reizt Haut, Augen und Schleimhäute. Darüber hinaus kann es die Umwelt verschmutzen.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3.6 Chemische Eigenschaften
- 3.7 Andere Eigenschaften
- 4 Synthese
- 5 Verwendungen
- 5.1 In der Farbstoffindustrie
- 5.2 In der analytischen Chemie
- 5.3 In der Medizin als antibakterielles Mittel
- 5.4 In der Medizin als Mukolytikum
- 5.5 In Bioassay-Labors
- 5.6 In der Papierindustrie
- 5.7 In Drucken, Gravuren oder Lithografien
- 5.8 In Baustoffen
- 6 Referenzen
Struktur
Sulfanilsäure hat weiße Kristalle, die durch orthorhombische oder monokline Schichten gebildet werden. Sein Monohydrat kristallisiert in Form von orthorhombischen Schichten in Wasser. Wenn die Kristallisation sehr langsam verläuft, kristallisiert das Dihydrat. Das Monohydrat wird wasserfrei, wenn es nahe bei 100 ° C liegt.
Nomenklatur
- Sulfanilsäure.
- P-Aminobenzolsulfonsäure.
- 4-Aminobenzolsulfonsäure.
Eigenschaften
Körperlicher Status
Weißer oder cremefarbener kristalliner Feststoff.
Molekulargewicht
173,19 g / mol.
Schmelzpunkt
Es zersetzt sich bei ca. 288 ° C ohne zu schmelzen. Es wird auch bei> 320 ºC berichtet.
Dichte
1,49 g / cm3
Löslichkeit
In Wasser fast unlöslich: 10,68 g / l bei 20 ºC.
Unlöslich in Ethanol, Benzol und Ether. In heißem Methanol schwer löslich.
Löslich in wässrigen Basenlösungen. Unlöslich in wässrigen Lösungen von Mineralsäuren. Löslich in konzentrierter Salzsäure.
Chemische Eigenschaften
Seine Eigenschaften unterscheiden sich von denen anderer amino- oder sulfonierter Verbindungen und ähneln denen eines Salzes. Dies liegt daran, dass seine Struktur tatsächlich die -NH-Gruppen enthält3+ Und so3-, das gibt es zwitterionische Eigenschaften.
Es enthält eine Säuregruppe und eine basische Gruppe an entgegengesetzten Polen desselben Moleküls. Aber das Wasserstoffion ist wegen der -NH-Gruppe an Stickstoff anstelle von Sauerstoff gebundenzwei ist eine stärkere Basis als die -SO-Gruppe3-.
Da es ein Zwitterion ist, hat es einen hohen Schmelzpunkt und Unlöslichkeit in organischen Lösungsmitteln..
Sulfanilsäure ist in alkalischer Lösung wegen des Hydroxidions OH löslich-, Da es stark basisch ist, startet es ein Wasserstoffion (H.+) der schwachen Grundgruppe -NHzwei, Bildung des in Wasser löslichen p-Aminobenzolsulfonation.
In saurer Lösung ändert sich die Struktur der Sulfanilsäure nicht, daher bleibt sie unlöslich.
Andere Eigenschaften
Beim Erhitzen zur Zersetzung entstehen giftige Dämpfe von Stickoxiden und Schwefel.
Die Exposition gegenüber Sulfanilsäure kann zu Symptomen wie Haut-, Augen- und Schleimhautreizungen führen. Es ist eine ätzende Verbindung.
Synthese
Es wird hergestellt, indem Anilin mit Schwefelsäure (H) umgesetzt wirdzweiSW4) bei hohen Temperaturen. Zunächst wird das saure Aniliniumsulfatsalz gebildet, das beim Erhitzen auf 180-200 ºC unter Bildung des substituierten Rings in para-Position reorganisiert wird, da es das stabilste Produkt ist.
Um es mit einem hohen Reinheitsgrad herzustellen, wird die Sulfonierung eines Gemisches aus Anilin und Sulfolan mit H.zweiSW4 bei 180-190 ºC.
Anwendungen
In der Farbstoffindustrie
Sulfanilsäure wird zur Synthese oder Herstellung verschiedener Farbstoffe wie Methylorange und Tartrazin verwendet. Dazu wird es diazotiert, wobei diazotierte Sulfanilsäure erzeugt wird..
Es ist wichtig zu beachten, dass Tartrazin als Farbstoff in Lebensmitteln verwendet wurde. Einmal aufgenommen, erzeugt es im menschlichen Körper bestimmte Metaboliten, einschließlich Sulfanilsäure, die möglicherweise für die Bildung reaktiver Sauerstoffspezies verantwortlich sind. Diese können Nieren- (Nieren) oder Lebergewebe (Leber) betreffen..

In der analytischen Chemie
Es wird als Reagenz bei der Bestimmung verschiedener chemischer Verbindungen, einschließlich Nitrite, verwendet..
In der Medizin als antibakterielles Mittel
Sulfanilamid, abgeleitet von Sulfanilsäure, findet Anwendung in der pharmazeutischen Industrie, da es eine antibakterielle Wirkung hat.
Im menschlichen Körper verwechseln ihn Bakterien mit p-Aminobenzoesäure, einem essentiellen Metaboliten. Diese Substitution bedeutet, dass sich die Bakterien nicht vermehren und absterben.
Ein anderes Derivat der Sulfanilsäure, das durch Kondensation mit anderen Verbindungen erhalten wird, hat ebenfalls antibakterielle Eigenschaften, die auf seiner Fähigkeit beruhen, Folsäure (ein Mitglied des Vitamin B-Komplexes) zu verdrängen..
Diese Verbindung kann oral eingenommen, intravenös injiziert oder extern in einer Salbe angewendet werden..
In der Medizin als Mukolytikum
Ein Derivat der Sulfanilsäure mit mukolytischer Aktivität wurde verwendet. Dies bedeutet, dass es eine verflüssigende Aktivität des Schleims darstellt, um den Schleim selbst oder sehr viskose biologische Flüssigkeiten aufzulösen.
Die Verbindung kann verwendet werden, um eine Verflüssigung von Schleim zu erzeugen, der von einem Gewebe aufgrund pathologischer Zustände produziert wird. Zum Beispiel eine Verstopfung der Atemwege oder die des Vaginaltrakts, unter anderem.
Wenn es um die Verflüssigung von Schleim in den Atemwegen geht, wird das Produkt durch Einatmen, Nasentropfen, Nebel, Aerosole oder Vernebler verabreicht. Es ist eine Behandlung für Menschen oder Säugetiere. Es ist eine stärkere Verbindung als solche, die auf Cystein basieren.

Es wird auch im Labor verwendet, wenn die Viskosität biologischer Flüssigkeiten verringert werden soll, um analytische Bestimmungen zu erleichtern..
In Bioanalyselabors
Diazotierte Sulfanilsäure (ein Derivat, das durch Umsetzen von Sulfanilsäure mit Natriumnitrit hergestellt wird) wird zur Bestimmung von Bilirubin verwendet.
Bilirubin ist ein gelbes Pigment, das in der Galle vorkommt. Überschüssiges Bilirubin im Blut ist eine Folge von Lebererkrankungen, hämatologischen (oder Blut-) Störungen oder Störungen der Gallenwege.
Um die Menge an Bilirubin im Blut zu messen, wird das von Sulfanilsäure abgeleitete Diazo mit Bilirubin unter Bildung des Azobilirubin-Komplexes umgesetzt, dessen Intensität mit einem Kolorimeter oder Spektrophotometer gemessen wird. Auf diese Weise wird der Bilirubingehalt im Blutserum bestimmt..
In der Papierindustrie
Sulfanilsäure ermöglicht die Synthese einer Papierpolitur, dh einer Verbindung, die ihr einen optischen Glanz oder ein weißes Aussehen verleiht, da sie die gelbe Farbe von natürlichem oder unbehandeltem Papier neutralisiert..

Es hat gegenüber anderen Verbindungen den Vorteil, dass es in relativ hohen Konzentrationen zur Behandlung von Papierzellstoff unter Bedingungen mit niedrigem pH-Wert verwendet werden kann, ohne die Gelbfärbung des Papiers zu erhöhen..
Das Ergebnis ist offensichtlich, wenn das Papier mit UV-Licht (ultraviolett) beobachtet wird, unter dem es viel stärker fluoresziert als wenn andere Verbindungen verwendet werden, und wenn sichtbares Licht beobachtet wird, dass der Vergilbungsgrad sehr gering ist.
Es ist in Wasser sehr gut löslich, wodurch es in konzentrierten Lösungen verwendet werden kann. Kann auf jeder Art von Papier verwendet werden, einschließlich Papier, das aus gemahlenem Holzzellstoff, Sulfitzellstoff oder einem anderen Verfahren hergestellt wird.
In Drucken, Gravuren oder Lithografien
Sulfanilsäure wirkt als Säuerungsmittel in konzentrierten Lösungen für die Lithographie, ohne die Probleme anderer Säuren wie Phosphorsäure darzustellen, da sie weniger toxisch und weniger umweltschädlich ist als letztere..
In Baumaterialien
Sulfanilsäure-modifizierte wässrige Melamin-Formaldehyd-Harzlösungen wurden in Beton (Beton), Mörtel oder Zementpaste getestet. Der Zweck bestand darin, den Wassergehalt zu verringern und eine Abnahme der Fließfähigkeit der Mischung im Laufe der Zeit zu verhindern, ohne die Abbindezeit zu verkürzen..
Mit diesen Lösungen hergestellter Beton oder Mörtel ist im Sommer sehr effektiv, wenn die Abnahme der Fließfähigkeit im Laufe der Zeit ein Problem darstellt..
Wenn mit diesen Lösungen der Mörtel oder Beton hergestellt wird und aus irgendeinem Grund ruhen muss, kann die Zementzusammensetzung leicht in Formen oder dergleichen gegossen werden, da sie im Laufe der Zeit nicht an Fließfähigkeit verloren hat..

Verweise
- Windholz, M. et al. (Herausgeber) (1983). Der Merck-Index. Eine Enzyklopädie der Chemikalien, Drogen und Biologika. Zehnte Ausgabe. Merck & CO., Inc..
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 2. Vierte Ausgabe. John Wiley & Sons.
- Nationalbibliothek für Medizin. (2019). Sulfanilsäure. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Urist, H. und Martin, G.J. (1950). Sulfanilsäurederivate. US-Patent Nr. 2,504,471. Beauftragte der National Drug Company. 18. April 1950.
- Villaume, Frederick G. (1964). Aufhellerzusammensetzung für Papier aus Methanil- und Sulfanilsäure. US-Patent Nr. 3,132,106. 5. Mai 1964.
- Martin, Tellis A. und Comer, William T. (1979). Benzoesäurederivat und benzolsulfonsäuremukolytischer Prozess. US-Patent Nr. 4,132,802. 2. Januar 1979.
- Druker, L.J. und Kincaid, R.B. (1979). Lithographisches Brunnenkonzentrat. US-Patent Nr. 4,150,996. 24. April 1979.
- Shull, Bruce C. (1983). Bilirubin-Assay. US-Patent Nr. 4,404,286. 13. September 1983.
- Uchida, J. et al. (2001). Verfahren zur Herstellung einer wässrigen Lösung von Sulfanilsäure-modifiziertem Melamin-Formaldehyd-Harz und einer Zementzusammensetzung. US-Patent Nr. 6,214,965 B1. 10. April 2001.
- Corradini, M.G. (2019). Band 1. In der Encyclopedia of Food Chemistry. Von sciencedirect.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.