
Struktur, Eigenschaften, Verwendung der Phosphorsäure (H3PO4)

Das Phosphorsäure Es ist eine Oxosäure des Phosphors, die die chemische Formel H hat3PO4. Es besteht aus einer Mineralsäure, in der drei saure Protonen an das Phosphatanion (PO) gebunden sind43-). Obwohl es nicht als starke Säure angesehen wird, kann seine unsachgemäße Verwendung ein Gesundheitsrisiko darstellen.
Es kann in zwei Zuständen gefunden werden: als Feststoff in Form von dicken orthorhombischen Kristallen oder als kristalline Flüssigkeit mit sirupartigem Aussehen. Die gebräuchlichste kommerzielle Präsentation hat eine Konzentration von 85 Gew .-% und eine Dichte von 1,685 g / cm3. Diese Dichte kommt aus der Hand der Konzentration.
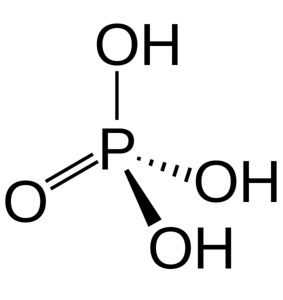
Die drei OH-Gruppen sind für die Abgabe von sauren Wasserstoffatomen verantwortlich. Aufgrund ihrer Anwesenheit in seiner Struktur kann es mit verschiedenen Hydroxiden reagieren, aus denen verschiedene Salze stammen.
Im Fall von Natriumhydroxid kann es drei bilden: einbasiges Natriumphosphat (NaH)zweiPO4), zweibasisches Natriumphosphat (NazweiHPO4) und tribasisches Natriumphosphat (Na3PO4).
Abhängig davon, welche Base für ihre Neutralisation verwendet wird oder welche Kationen sehr nahe daran liegen, kann sie jedoch andere Phosphatsalze bilden. Unter ihnen sind: Calciumphosphat (Ca.3(PO4)zwei), Lithiumphosphat (Li3PO4), Eisen (III) -phosphat (FePO4), und andere. Jedes mit seinen unterschiedlichen Protonierungsgraden des Phosphatanions.
Andererseits kann Phosphorsäure zweiwertige Kationen wie Fe "sequestrieren"zwei+, Cuzwei+, ACzwei+ und Mgzwei+. Bei erhöhten Temperaturen kann es mit dem Verlust eines H-Moleküls mit sich selbst reagierenzweiOder unter Bildung von Dimeren, Trimeren und Polymeren von Phosphorsäuren.
Diese Art der Reaktion macht diese Verbindung in der Lage, eine große Anzahl von Strukturen mit Phosphor- und Sauerstoffgerüsten aufzubauen, aus denen auch eine breite Palette von Salzen erhalten werden kann, die als Polyphosphate bekannt sind..
In Bezug auf seine Entdeckung wurde es 1694 von Robert Boyle synthetisiert und P aufgelöstzweiODER5 (Phosphorpentoxid) in Wasser. Es ist eine der nützlichsten Mineralsäuren, wobei seine Funktion als Dünger am wichtigsten ist. Phosphor bildet neben Kalium und Stickstoff die drei wichtigsten Pflanzennährstoffe.
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Diphosphorsäure (H4P2O7)
- 1.2 Polyphosphorsäuren
- 1.3 Cyclische Polyphosphorsäuren
- 2 Nomenklatur
- 2.1 Ortho
- 2.2 Pyro
- 2.3 Ziel
- 3 Eigenschaften
- 3.1 Summenformel
- 3.2 Molekulargewicht
- 3.3 Aussehen
- 3.4 Siede- und Schmelzpunkte
- 3.5 Löslichkeit in Wasser
- 3.6 Dichte
- 3.7 Dampfdichte
- 3.8 Selbstentzündung
- 3.9 Viskosität
- 3.10 Säure
- 3.11 Zersetzung
- 3.12 Korrosivität
- 3.13 Polymerisation
- 4 Verwendungen
- 4.1 Phosphatsalze und allgemeine Verwendungen
- 4.2 Industrie
- 4.3 Dental
- 4.4 Kosmetik
- 5 Bildung von Phosphorsäure
- 6 Risiken
- 7 Referenzen
Chemische Struktur
Phosphorsäure besteht aus einer P = O-Bindung und drei P-OH, wobei letztere die Träger der in einem Auflösungsmedium freigesetzten sauren Wasserstoffatome sind. Mit dem Phosphoratom im Zentrum ziehen die Sauerstoffatome eine Art molekulares Tetraeder.
Auf diese Weise kann Phosphorsäure als Tetraeder dargestellt werden. Aus dieser Perspektive, sagte Tetraeder (in Einheiten von H.3PO4) über Wasserstoffbrücken miteinander interagieren; das heißt, seine Eckpunkte nähern sich eng an.
Diese intermolekularen Wechselwirkungen ermöglichen die Kristallisation von Phosphorsäure in zwei Feststoffe: das wasserfreie und das Hemihydrat (H.3PO41 / 2HzweiO), beide mit monoklinen Kristallsystemen. Seine wasserfreie Form kann auch durch die Formel 3H beschrieben werdenzweiO · P.zweiODER5, das ist gleich einem trihydratisierten Phosphorpentoxid.
Tetraeder können sogar kovalent verknüpft werden, aber dafür muss eine ihrer Einheiten ein Wassermolekül durch Dehydratisierung eliminieren. Dies tritt auf, wenn der H.3PO4 wird erhitzt und erzeugt folglich die Bildung von Polyphosphorsäuren (PA).
Diphosphorsäure (H.4P.zweiODER7)
Die einfachste aller PAs ist Diphosphorsäure (H.4P.zweiODER7), auch als Pyrophosphorsäure bekannt. Die chemische Gleichung seiner Bildung lautet wie folgt:
2H3PO4 <=> H.4P.zweiODER7 + H.zweiODER
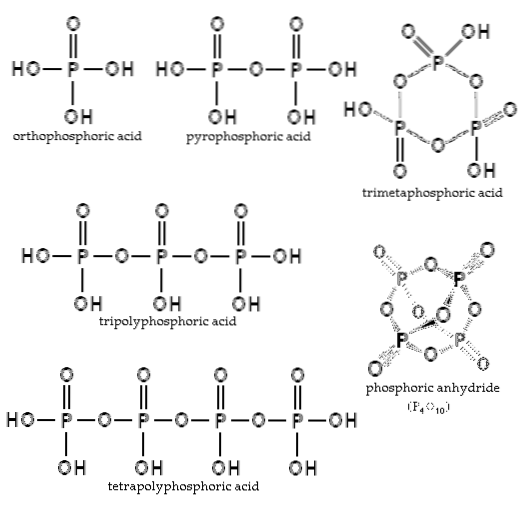
Das Gleichgewicht hängt von der Wassermenge und der Temperatur ab. Wie ist ihre Struktur? In der Abbildung des Abschnitts sind die Strukturen von Orthophosphorsäure und Pyrophosphorsäure in der oberen linken Ecke dargestellt..
Zwei Einheiten werden kovalent verbunden, wenn ein Wassermolekül eliminiert wird, und bilden eine P-O-P-Sauerstoffbrücke zwischen ihnen. Jetzt sind es nicht drei saure Wasserstoffatome, sondern vier (vier -OH-Gruppen). Aus diesem Grund ist der H.4P.zweiODER7 hat vier Ionisationskonstanten kzu.
Polyphosphorsäuren
Die Dehydratisierung kann mit Pyrophosphorsäure fortgesetzt werden, wenn das Erhitzen fortgesetzt wird. Warum? Denn an jedem Ende seines Moleküls befindet sich eine OH-Gruppe, die als Wassermolekül entfernt werden kann und so das nachfolgende Wachstum des P-O-P-O-P-Gerüsts fördert ...
Beispiele für diese Säuren sind Tripolyphosphorsäure und Tetrapolyphosphorsäure (beide im Bild dargestellt). Es ist zu sehen, wie sich das P-O-P-Rückgrat in einer Art Kette aus Tetraedern verlängert.
Diese Verbindungen können durch die Formel HO (PO) dargestellt werdenzweiOH)xH, wobei HO die äußerste Linke ist, die dehydriert werden kann. POzweiOH ist das Phosphorrückgrat mit den P = O- und OH-Bindungen; und x sind die Einheiten oder Moleküle von Phosphorsäuren, die notwendig sind, um die Kette zu erhalten.
Wenn diese Verbindungen mit einer Base vollständig neutralisiert sind, entstehen sogenannte Polyphosphate. Je nachdem, welche Kationen sie umgeben, bilden sie eine Vielzahl von Polyphosphatsalzen.
Wenn sie andererseits mit ROH-Alkoholen reagieren, werden ihre Rückgratwasserstoffe durch die R-Alkylsubstituenten ersetzt. Somit entstehen die Phosphatester (oder Polyphosphate): RO (POzweiODER)xR. Es reicht aus, das H in allen Strukturen des Abschnittsbildes durch R zu ersetzen, um sie zu erhalten.
Cyclische Polyphosphorsäuren
Die P-O-P-Ketten können sich sogar an einem Phosphorring oder -zyklus schließen. Die einfachste dieser Art von Verbindung ist Trimetaphosphorsäure (obere rechte Bildecke). Somit können APs linear und zyklisch sein; oder wenn ihre Strukturen beide Typen aufweisen, verzweigt.
Nomenklatur
Die Nomenklatur der Phosphorsäure wird von der IUPAC vorgegeben und wie die ternären Salze der Oxosäuren benannt werden.
Weil in der H.3PO4 Das P-Atom hat die Wertigkeit +5, den höchsten Wert, seine Säure erhält das Suffix -ico für das Präfix Leuchtstoff-.
Ortho
Phosphorsäure wird jedoch üblicherweise auch als Orthophosphorsäure bezeichnet. Warum? Weil das Wort "ortho" griechisch ist und "wahr" bedeutet; was in die "wahre Form" oder "hydratisierter" derselben übersetzen würde.
Wenn wasserfreies Phosphor mit einem Überschuss an Wasser hydratisiert wird (P.4ODER10, Die Leuchtstoffkappe im obigen Bild wird mit H erzeugt3PO4 (3HzweiO · P.zweiODER5). Somit wird das Präfix ortho den Säuren zugeordnet, die mit reichlich Wasser gebildet werden.
Pyro
Das Präfix Pyro bezieht sich auf jede Verbindung, die nach Anwendung von Wärme entsteht, da Diphosphorsäure aus der thermischen Dehydratisierung von Phosphorsäure entsteht. Es wird daher Pyrophosphorsäure (2H) genanntzweiO · P.zweiODER5).
Tor
Das Präfix Meta, das auch ein griechisches Wort ist, bedeutet "nach". Es wird jenen Substanzen zugesetzt, deren Formel ein Molekül eliminiert hat, in diesem Fall das von Wasser:
H.3PO4 => HPO3 + H.zweiODER
Es ist zu beachten, dass diesmal die Zugabe von zwei Phosphoreinheiten nicht zur Bildung von Diphosphorsäure erfolgt, sondern stattdessen Metaphosphorsäure erhalten wird (von der es keine Hinweise auf ihre Existenz gibt)..
Es ist auch wichtig zu beachten, dass diese Säure als H beschrieben werden kannzweiO · P.zweiODER5 (ähnlich wie Hemidrate, Multiplikation von HPO3 Für 2). Das Meta-Präfix passt perfekt zu cyclischem PA, da die Triphosphorsäure dehydriert, aber keine weitere H-Einheit hinzufügt3PO4 Um Tetraphosphorsäure zu werden, muss sie einen Ring bilden.
Dies gilt auch für andere Polymetaphosphorsäuren, obwohl die IUPAC empfiehlt, sie als cyclische Verbindungen der entsprechenden PAs zu bezeichnen..
Eigenschaften
Molekularformel
H.3PO4
Molekulargewicht
97,994 g / mol
Aussehen
In seiner festen Form präsentiert es orthorhombische, hygroskopische und transparente Kristalle. In flüssiger Form ist es kristallin mit dem Aussehen eines viskosen Sirups..
Es ist im Handel in wässriger Lösung mit einer Konzentration von 85 Gew .-% erhältlich. In all diesen Präsentationen fehlt es an Geruch.
Siede- und Schmelzpunkte
158ºC (316ºF bei 760 mmHg).
42,2 ° C.
Wasserlöslichkeit
548 g / 100 g H.zweiOder bei 20 ° C; 369,4 g / 100 ml bei 0,5 ° C; 446 g / 100 m bei 14,95 ° C..
Dichte
1,892 g / cm3 (solide); 1,841 g / cm3 (100% ige Lösung); 1,685 g / cm3 (85% ige Lösung); 1,334 g / cm3 50% ige Lösung) bei 25 ° C..
Wasserdampfdichte
Relativ zu Luft 3,4 (Luft = 1).
Selbstentzündung
Es ist nicht brennbar.
Viskosität
3,86 mPoise (40% ige Lösung bei 20 ° C).
Säure
pH: 1,5 (0,1 N Lösung in Wasser)
pKa: pKa1 = 2,148; pKa2 = 7,198 und pKa3 = 12,319. Daher ist Ihr sauerster Wasserstoff der erste.
Zersetzung
Beim Erhitzen werden Phosphoroxide freigesetzt. Wenn die Temperatur auf 213 ° C oder mehr steigt, wird es zu Pyrophosphorsäure (H.4P.zweiODER7).
Korrosivität
Ätzend gegenüber Eisenmetallen und Aluminium. Durch die Reaktion mit diesen Metallen entsteht das Brenngas Wasserstoff.
Polymerisation
Polymerisiert heftig mit Azoverbindungen, Epoxiden und polymerisierbaren Verbindungen.
Anwendungen
Phosphatsalze und allgemeine Verwendungen
-Phosphorsäure dient als Grundlage für die Herstellung von Phosphaten, die als Düngemittel verwendet werden, da Phosphor ein Hauptnährstoff in Pflanzen ist..
-Es wurde zur Behandlung von Bleivergiftungen und anderen Zuständen verwendet, bei denen erhebliche Mengen an Phosphat erforderlich sind, und zur Erzeugung einer leichten Azidose.
-Es wird verwendet, um den pH-Wert der Nerzharnwege und die Kosten zu kontrollieren, um die Bildung von Nierensteinen zu vermeiden.
-Phosphorsäure führt zu Na-SalzenzweiHPO4 und NaHzweiPO4 die ein pH-Puffersystem mit einem pKa von 6,8 bilden. Dieses pH-regulierende System ist beim Menschen vorhanden und wichtig für die Regulierung des intrazellulären pH-Werts sowie für das Management der Wasserstoffkonzentration in den distalen und Sammelröhrchen der Nephrone..
-Es wird zur Entfernung der schimmeligen Eisenoxidschicht verwendet, die sich auf diesem Metall ansammelt. Phosphorsäure bildet Eisenphosphat, das leicht von der Metalloberfläche entfernt werden kann. Es wird auch beim elektrischen Polieren von Aluminium verwendet und ist ein Bindemittel für feuerfeste Produkte wie Aluminiumoxid und Magnesiumoxid..
Industriell
-Phosphorsäure wird als Katalysator bei der Herstellung von Nylon und Benzin verwendet. Es wird als Dehydratisierungsmittel bei der lithografischen Gravur, bei der Herstellung von Farbstoffen zur Verwendung in der Textilindustrie, beim Latexkoagulationsverfahren in der Kautschukindustrie und bei der Reinigung von Wasserstoffperoxid verwendet.
-Die Säure wird als Zusatz in kohlensäurehaltigen Getränken verwendet und trägt so zu ihrem Geschmack bei. Verdünnt wird beim Zuckerraffinieren angewendet. Es wirkt auch als Puffersystem bei der Herstellung von Schinken, Gelatine und Antibiotika..
-Es ist an der Herstellung von Waschmitteln und an der Säurekatalyse der Acetylenproduktion beteiligt.
-Es wird als Säuerungsmittel in ausgewogenen Lebensmitteln für die Viehwirtschaft und Haustiere verwendet. Die Pharmaindustrie verwendet es bei der Herstellung von Antiemetika. Es wird auch in einer Mischung verwendet, um Asphalt herzustellen, um den Boden zu ebnen und Risse zu reparieren..
-Phosphorsäure wirkt als Katalysator bei der Hydratationsreaktion von Alkenen unter Bildung von Alkohol, hauptsächlich Ethanol. Darüber hinaus wird es zur Bestimmung von organischem Kohlenstoff in Böden verwendet.
Dental
Es wird von Zahnärzten verwendet, um die Zahnoberfläche vor dem Einsetzen von Zahnspangen zu reinigen und zu konditionieren. Es findet auch Verwendung bei der Zahnaufhellung und der Entfernung von Zahnbelägen. Darüber hinaus wird es zur Herstellung von Klebstoffen für Zahnersatz verwendet.
Kosmetika
Phosphorsäure wird verwendet, um den pH-Wert in Kosmetik- und Hautpflegeprodukten einzustellen. Es wird als chemisches Oxidationsmittel zur Herstellung von Aktivkohle verwendet..
Bildung von Phosphorsäure
-Phosphorsäure wird aus Phosphatgesteinen vom Apatit-Typ durch Aufschluss mit konzentrierter Schwefelsäure hergestellt:
AC3(PO4)zwei + 3 H.zweiSW4 + 6 hzweiO => 2 H.3PO4 + 3 (CaSO4.2HzweiODER)
Die bei dieser Reaktion erhaltene Phosphorsäure ist von geringer Reinheit, so dass sie einem Reinigungsprozess unterzogen wird, der Fällungs-, Lösungsmittelextraktions-, Kristallisations- und Ionenaustauschtechniken umfasst..
-Phosphorsäure kann durch Auflösen von Phosphorpentoxid in kochendem Wasser hergestellt werden.
-Es kann auch durch Erhitzen von Phosphor mit einem Gemisch aus Luft und Wasserdampf erhalten werden:
P.4 (l) + 5 O.zwei (g) => P.4ODER10 (s)
P.4ODER10 (s) + H.zweiO (g) => 4H3PO4 (l)
Risiken
-Da sein Dampfdruck bei Raumtemperatur niedrig ist, ist es unwahrscheinlich, dass seine Dämpfe eingeatmet werden, wenn keine Säure versprüht wird. Wenn ja, sind Ihre Inhalationssymptome: Husten, Halsschmerzen, Atemnot und Atemnot..
-In der Literatur wird der Fall eines Seemanns angeführt, der lange Zeit Phosphorsäuredämpfen ausgesetzt war. Er litt unter allgemeiner Schwäche, trockenem Husten, Brustschmerzen und Atemproblemen. Innerhalb eines Jahres nach der Exposition wurde eine reaktive Atemwegsstörung beobachtet.
-Hautkontakt mit Phosphorsäure kann Rötungen, Schmerzen, Blasen und Verbrennungen der Haut verursachen..
-Der Kontakt der Säure mit den Augen kann je nach Konzentration und Kontaktdauer zu Verletzungen des ätzenden Gewebes oder schweren Verbrennungen mit bleibenden Augenschäden führen..
-Die Einnahme der Säure verursacht ein Brennen von Mund und Rachen, ein brennendes Gefühl jenseits des Brustbeins, Bauchschmerzen, Erbrechen, Schock und Kollaps.
Verweise
- Royal Society of Chemistry. (2015). Phosphorsäure. Entnommen aus: chemspider.com
- Kanadisches Zentrum für Sicherheit und Gesundheitsschutz am Arbeitsplatz. (1999). Phosphorsäure - Auswirkungen auf die Gesundheit. Entnommen aus: ccsso.ca
- Acids.Info. (2018). Phosphorsäure "Vielzahl von Verwendungen dieser chemischen Verbindung. Entnommen aus: acidos.info
- James P. Smith, Walter E. Brown und James R. Lehr. (1955). Struktur der kristallinen Phosphorsäure. J. Am. Chem. Soc. 77, 10, 2728 & ndash; 2730
- Wikipedia. (2018). Phosphorsäuren und Phosphate. Entnommen aus: en.wikipedia.org
- Wissenschaft macht Spaß. Erfahren Sie mehr über Phosphorsäure. [PDF]. Entnommen aus: scifun.chem.wisc.edu



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.