
Chromsäurestruktur, Eigenschaften, Herstellung, Verwendung

Das Chromsäure oder H.zweiCrO4 Es ist theoretisch die Säure, die mit Chrom (VI) oxid oder Chromoxid CrO assoziiert ist3. Dieser Name ist darauf zurückzuführen, dass die Art H.zweiCrO4 ist zusammen mit anderen Chromarten vorhanden (VI).
Chromoxid CrO3 es wird auch wasserfreie Chromsäure genannt. Der CrO3 ist ein rotbrauner oder violetter Feststoff, der durch Behandeln von Lösungen von Kalium-K-Dichromat erhalten wirdzweiCrzweiODER7 mit Schwefelsäure H.zweiSW4.

Wässrige Chromoxidlösungen erfahren ein Gleichgewicht bestimmter chemischer Spezies, deren Konzentration vom pH-Wert der Lösung abhängt. Bei basischem pH überwiegen die Chromationen CrO4zwei-, während bei saurem pH die HCrO-Ionen überwiegen4- und Cr-DichromatzweiODER7zwei-. Es wird geschätzt, dass bei saurem pH-Wert auch Chromsäure H vorhanden istzweiCrO4.
Aufgrund ihrer großen Oxidationskraft werden Chromsäurelösungen in der organischen Chemie zur Durchführung von Oxidationsreaktionen eingesetzt. Sie werden auch in elektrochemischen Prozessen eingesetzt, um Metalle so zu behandeln, dass sie korrosions- und verschleißfest sind..
Bestimmte polymere Materialien werden auch mit Chromsäure behandelt, um ihre Haftung an Metallen, Farben und anderen Substanzen zu verbessern..
Chromsäurelösungen sind für Menschen, die meisten Tiere und die Umwelt sehr gefährlich. Aus diesem Grund werden flüssige oder feste Abfälle aus Prozessen, bei denen Chromsäure verwendet wird, behandelt, um Spuren von Chrom (VI) zu entfernen oder um das gesamte vorhandene Chrom wiederzugewinnen und die Chromsäure zur Wiederverwendung zu regenerieren..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3.6 Andere Eigenschaften
- 4 Chemie wässriger Lösungen, in denen Chromsäure vorhanden ist
- 5 Erhalten
- 6 Verwendung von Chromsäure
- 6.1 Bei der Oxidation chemischer Verbindungen
- 6.2 Bei Metallanodisierungsprozessen
- 6.3 Bei chemischen Umwandlungsbehandlungen
- 6.4 In erodierten oder narbigen Oberflächen
- 6.5 In verschiedenen Anwendungen
- 7 Chromsäurerückgewinnung
- 7.1 Durch Verwendung von Harzen
- 7.2 Durch elektrochemische Regeneration
- 8 Verwendung von Mikroorganismen zur Reinigung von Abwässern mit Spuren von Chromsäure
- 9 Risiken von Chromsäure und Chromoxid
- 10 Referenzen
Struktur
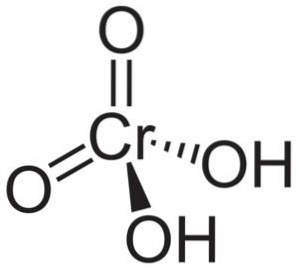
Chromsäuremolekül H.zweiCrO4 es wird durch ein Chromation CrO gebildet4zwei- und zwei Wasserstoffionen H.+ damit verbunden. Im Chromation befindet sich das Element Chrom in einer Oxidationsstufe von +6.
Die räumliche Struktur des Chromations ist tetraedrisch, wobei sich Chrom im Zentrum befindet und Sauerstoff die vier Eckpunkte des Tetraeders einnimmt..
In Chromsäure sind die Wasserstoffatome jeweils zusammen mit einem Sauerstoff. Von den vier Chrombindungen mit den Sauerstoffatomen sind zwei doppelt und zwei einfach, da an sie die Wasserstoffatome gebunden sind.
Andererseits Chromoxid CrO3 hat ein Chromatom in der Oxidationsstufe +6, das nur von drei Sauerstoffatomen umgeben ist.
Nomenklatur
- Chromsäure H.zweiCrO4
- Tetraoxochromsäure H.zweiCrO4
- Chromoxid (wasserfreie Chromsäure) CrO3
- Chromtrioxid (wasserfreie Chromsäure) CrO3
Eigenschaften
Körperlicher Status
Wasserfreie Chromsäure oder Chromoxid ist ein violetter bis roter kristalliner Feststoff
Molekulargewicht
CrO3: 118,01 g / mol
Schmelzpunkt
CrO3: 196 ºC
Oberhalb seines Schmelzpunktes ist es thermisch instabil, es verliert Sauerstoff (wird reduziert), um Chrom (III) oxid Cr zu ergebenzweiODER3. Es zersetzt sich bei ca. 250 ºC.
Dichte
CrO3: 1,67-2,82 g / cm3
Löslichkeit
Der CrO3 es ist in Wasser sehr gut löslich: 169 g / 100 g Wasser bei 25 ºC.
Es ist löslich in Mineralsäuren wie Schwefelsäure und Salpetersäure. In Alkohol löslich.
Andere Eigenschaften
Der CrO3 es ist sehr hygroskopisch, seine Kristalle zerfließen.
Wenn der CrO3 löst sich in Wasser und bildet stark saure Lösungen.
Es ist ein sehr starkes Oxidationsmittel. Oxidiert organische Stoffe in fast allen ihren Formen kräftig. Greift Stoff, Leder und einige Kunststoffe an. Greift auch die meisten Metalle an.
Es ist stark giftig und aufgrund seines hohen Oxidationspotentials sehr reizend..
Chemie wässriger Lösungen, in denen Chromsäure vorhanden ist
Chromoxid CrO3 löst sich schnell in Wasser auf. In wässriger Lösung kann Chrom (VI) in verschiedenen ionischen Formen vorliegen.
Bei pH> 6,5 oder in alkalischer Lösung nimmt Chrom (VI) die Chromationenform CrO an4zwei- Gelb.
Wenn der pH-Wert gesenkt wird (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , welches zu Cr-Dichromation dimerisieren kannzweiODER7zwei-, und die Lösung wird orange. Bei einem pH-Wert zwischen 2,5 und 5,5 sind HCrO die vorherrschenden Spezies4- und CRzweiODER7zwei-.

Die Gleichgewichte, die in diesen Lösungen auftreten, wenn der pH-Wert abnimmt, sind die folgenden:
CrO4zwei- (Chromation) + H.+ ⇔ HCrO4-
HCrO4- + H.+ ⇔ H.zweiCrO4 (Chromsäure)
2HCrO4- ⇔ CrzweiODER7zwei- (Dichromation) + H.zweiODER
Diese Gleichgewichte treten nur auf, wenn die Säure, die zur Senkung des pH-Werts zugesetzt wird, HNO ist3 oder HClO4, weil mit anderen Säuren unterschiedliche Verbindungen gebildet werden.
Saure Dichromatlösungen sind sehr starke Oxidationsmittel. In alkalischen Lösungen ist das Chromation jedoch viel weniger oxidierend.
Erhalten
Nach den konsultierten Quellen ist eine der Möglichkeiten, Chromoxid CrO zu erhalten3, Dies besteht aus der Zugabe von Schwefelsäure zu einer wässrigen Lösung von Natrium- oder Kaliumdichromat unter Bildung eines rot-orangefarbenen Niederschlags..

Chromsäure H.zweiCrO4 Es wird in wässrigen Chromoxidlösungen in einem sauren Medium gefunden.
Chromsäure verwendet
Bei der Oxidation chemischer Verbindungen
Aufgrund seiner stark oxidierenden Fähigkeit wird Chromsäure seit langem erfolgreich zur Oxidation organischer und anorganischer Verbindungen eingesetzt..
Unter unzähligen Beispielen sind die folgenden: Es ermöglicht die Oxidation von primären Alkoholen zu Aldehyden und diese zu Carbonsäuren, sekundären Alkoholen zu Ketonen, Toluol zu Benzoesäure, Ethylbenzol zu Acetophenon, Triphenylmethan zu Triphenylcarbinol, Ameisensäure zu COzwei, Oxalsäure zu COzwei, Milchsäure zu Acetaldehyd und COzwei, Eisenionen Fezwei+ zu Eisen (III) -Ion Fe3+, Jodidionen zu Jod usw..
Es ermöglicht die Umwandlung von Nitrosoverbindungen in Nitroverbindungen, Sulfide in Sulfone. Es ist an der Synthese von Ketonen ausgehend von Alkenen beteiligt, da es hydroborierte Alkene zu Ketonen oxidiert.
Verbindungen, die gegenüber üblichen Oxidationsmitteln wie Sauerstoff O sehr beständig sindzwei oder Wasserstoffperoxid H.zweiODERzwei, Sie werden durch Chromsäure oxidiert. Dies ist bei bestimmten heterocyclischen Boranen der Fall.
In Metallanodisierungsprozessen
Die Chromsäureanodisierung ist eine elektrochemische Behandlung von Aluminium, um es über viele Jahre vor Oxidation, Korrosion und Verschleiß zu schützen..
Der Anodisierungsprozess beinhaltet die elektrochemische Bildung einer Schicht aus Aluminiumoxid oder Aluminiumoxid auf dem Metall. Diese Schicht wird dann in heißem Wasser versiegelt, wodurch die Umwandlung in Aluminiumoxidtrihydrat erreicht wird..
Die versiegelte Oxidschicht ist dick, aber strukturell schwach und für die anschließende Verklebung nicht sehr zufriedenstellend. Durch Zugabe einer kleinen Menge Chromsäure zum Versiegelungswasser entsteht jedoch eine Oberfläche, die gute Bindungen bilden kann..
Die Chromsäure im Versiegelungswasser löst einen Teil der grobzelligen Struktur auf und hinterlässt eine dünne, starke, fest haftende Aluminiumoxidschicht, an der die Klebstoffe haften und starke und dauerhafte Bindungen bilden..
Die Chromsäureanodisierung gilt auch für Titan und seine Legierungen.
Bei chemischen Umwandlungsbehandlungen
Chromsäure wird in Metallbeschichtungsprozessen durch chemische Umwandlung verwendet.
Während dieses Prozesses werden Metalle in Chromsäurelösungen eingetaucht. Dies reagiert und löst die Oberfläche teilweise auf, während eine dünne Schicht komplexer Chromverbindungen abgeschieden wird, die mit dem Grundmetall interagieren..
Dieser Vorgang wird als Chromatumwandlungsbeschichtung oder Umwandlungsverchromung bezeichnet..
Die Metalle, die im Allgemeinen einer Umwandlungsverchromung unterzogen werden, sind verschiedene Stahlsorten wie Kohlenstoffstahl, Edelstahl und verzinkter Stahl sowie verschiedene Nichteisenmetalle wie Magnesiumlegierungen, Zinnlegierungen, Aluminiumlegierungen und Kupfer. , Cadmium, Mangan und Silber.
Diese Behandlung verleiht dem Metall Korrosionsbeständigkeit und Glanz. Je höher der pH-Wert des Prozesses ist, desto größer ist die Korrosionsbeständigkeit. Die Temperatur beschleunigt die Säurereaktion.
Es können Beschichtungen in verschiedenen Farben wie Blau, Schwarz, Gold, Gelb und Klar aufgetragen werden. Es bietet auch eine bessere Haftung der Metalloberfläche auf Farben und Klebstoffen.
In erodierten oder narbigen Oberflächen
Chromsäurelösungen werden zur Vorbereitung der Oberfläche von Gegenständen aus thermoplastischem Material, duroplastischen Polymeren und Elastomeren für deren anschließende Beschichtung mit Farben oder Klebstoffen verwendet..
Die H.zweiCrO4 Es wirkt sich auf die Chemie der Oberfläche und ihre Struktur aus, da es dazu beiträgt, ihre Rauheit zu erhöhen. Die Kombination von Lochfraß und Oxidation erhöht das Eindringen der Klebstoffe und kann sogar Änderungen der Eigenschaften des Polymers verursachen..
Es wurde verwendet, um verzweigtes Polyethylen niedriger Dichte, lineares Polyethylen hoher Dichte und Polypropylen zu erodieren.
Es ist in der Galvanik- oder Galvanikindustrie weit verbreitet, um die Metall-Polymer-Haftung zu erleichtern.
In verschiedenen Anwendungen
Chromsäure wird als Holzschutzmittel auch in magnetischen Materialien und zur Katalyse chemischer Reaktionen eingesetzt.
Chromsäurerückgewinnung
Es gibt viele Verfahren, bei denen Chromsäure verwendet wird und die Ströme oder Rückstände erzeugen, die Chrom (III) enthalten, die nicht entsorgt werden können, weil sie Chrom (VI) -Ionen enthalten, die sehr toxisch sind, und die auch nicht wiederverwendet werden können, weil die Konzentration der Chromationen sehr hoch ist niedrig..
Ihre Entsorgung erfordert die chemische Reduktion von Chromaten zu Chrom (III), gefolgt von der Ausfällung des Hydroxids und der Filtration, was zusätzliche Kosten verursacht.
Aus diesem Grund wurden verschiedene Methoden untersucht, um Chromate zu entfernen und wiederzugewinnen. Hier sind einige davon.
Durch die Verwendung von Harzen
Ionenaustauscherharze werden seit vielen Jahren zur Behandlung von mit Chromaten kontaminiertem Wasser verwendet. Dies ist eine der von der US Environmental Protection Agency (EPA) zugelassenen Behandlungen. Umweltschutzbehörde).
Dieses Verfahren ermöglicht die Gewinnung von konzentrierter Chromsäure, da diese aus dem Harz wieder regeneriert wird..
Die Harze können stark oder schwach sein. In stark basischen Harzen kann das Chromat wegen der HCrO-Ionen entfernt werden4- und CRzweiODER7zwei- werden mit OH-Ionen ausgetauscht- und Cl-. In schwach basischen Harzen, beispielsweise Sulfatharzen, werden Ionen mit SO ausgetauscht4zwei-.
Bei den stark basischen R- (OH) -Harzen sind die Gesamtreaktionen wie folgt:
2ROH + HCrO4- + H.+ ⇔ R.zweiCrO4 + 2HzweiODER
R.zweiCrO4 + 2HCrO4- R 2RHCrO4 + CrO4zwei-
R.zweiCrO4 + HCrO4- + H.+ ⇔ R.zweiCrzweiODER7 + H.zweiODER
Für jedes Mol R.zweiCrO4 umgewandelt wird ein Mol Cr (VI) aus der Lösung entfernt, was dieses Verfahren sehr attraktiv macht..
Nach dem Entfernen der Chromate wird das Harz mit einer stark alkalischen Lösung behandelt, um sie an einem sicheren Ort zu regenerieren. Dann werden die Chromate in konzentrierte Chromsäure umgewandelt, um wiederverwendet zu werden..
Durch elektrochemische Regeneration
Eine andere Methode ist die elektrochemische Regeneration von Chromsäure, die ebenfalls eine sehr bequeme Alternative darstellt. Durch diesen Prozess wird Chrom (III) anodisch zu Chrom (VI) oxidiert. Das Anodenmaterial ist in diesen Fällen vorzugsweise Bleidioxid..
Verwendung von Mikroorganismen zur Reinigung von Abwässern mit Spuren von Chromsäure
Eine Methode, die untersucht wurde und noch untersucht wird, ist die Verwendung von Mikroorganismen, die natürlicherweise in bestimmten Abwässern vorhanden sind, die mit sechswertigen Chromionen kontaminiert sind, die in Chromsäurelösungen enthalten sind..

Dies ist der Fall bei bestimmten Bakterien, die im Ledergerbstoffabwasser vorhanden sind. Diese Mikroben wurden untersucht und es wurde festgestellt, dass sie gegen Chromat resistent sind und auch Chrom (VI) zu Chrom (III) reduzieren können, das für die Umwelt und Lebewesen viel weniger schädlich ist..
Aus diesem Grund wird geschätzt, dass sie als umweltfreundliche Methode zur Sanierung und Entgiftung von Abwässern verwendet werden können, die mit Spuren von Chromsäure kontaminiert sind..
Gefahren durch Chromsäure und Chromoxid
Der CrO3 Es ist nicht brennbar, kann aber die Verbrennung anderer Substanzen verstärken. Viele ihrer Reaktionen können Feuer oder Explosion verursachen.
Der CrO3 und Chromsäurelösungen sind starke Reizstoffe für Haut (kann Dermatitis verursachen), Augen (kann brennen) und Schleimhäute (kann Bronchoasma verursachen) und können sogenannte "Chromlöcher" in den Atemwegen verursachen.
Chrom (VI) -Verbindungen wie Chromsäure und Chromoxid sind für die meisten Lebewesen stark toxisch, mutagen und krebserregend..
Verweise
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- UNS. Nationalbibliothek für Medizin. (2019). Chromsäure. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. und Van Twisk, J. (2013). Aluminium und Aluminiumlegierungen. 2.5. Chromsäureanodisierungsprozess. In Oberflächenvorbereitungstechniken für das Kleben (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Wegman, R.F. und Van Twisk, J. (2013). Magnesium. 6.4. Herstellung von Magnesium und Magnesiumlegierungen durch Chromsäurebehandlungsverfahren. In Oberflächenvorbereitungstechniken für das Kleben (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Grot, W. (2011). Anwendungen. 5.1.8. Chromsäureregeneration. In fluorierten Ionomeren (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Swift, K.G. und Booker, J.D. (2013). Oberflächentechnische Prozesse. 9.7. Chromatieren. Im Handbuch zur Auswahl des Herstellungsprozesses. Von sciencedirect.com wiederhergestellt.
- Poulsson, A.H.C. et al. (2019). Oberflächenmodifikationstechniken von PEEK, einschließlich Plasma-Oberflächenbehandlung. 11.3.2.1. Oberflächenätzen. Im PEEK Biomaterials Handbook (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Westheimer, F.H. (1949). Die Mechanismen der Chromsäureoxidation. Chemical Reviews 1949, 45, 3, 419-451. Von pubs.acs.org wiederhergestellt.
- Tan, H.K.S. (1999). Entfernung von Chromsäure durch Anionenaustausch. The Canadian Journal of Chemical Engineering, Band 77, Februar 1999. Wiederhergestellt von onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Isolierung und Charakterisierung von Chrom (VI) -reduzierenden Bakterien aus Gerbereiabwässern und festen Abfällen. World Journal of Microbiology and Biotechnology (2018) 34: 126. Von ncbi.nlm.nih.gov wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.