
Propansäureformel, Eigenschaften, Risiken und Verwendungen

Das Propansäure ist eine kurzkettige gesättigte Fettsäure, die Ethan umfasst, das an den Kohlenstoff einer Carboxygruppe gebunden ist. Seine Formel lautet CH3-CHzwei-COOH. Das CH3CH2COO-Anion sowie die Salze und Ester der Propansäure werden als Propionate (oder Propanoate) bezeichnet..
Es kann aus Holzzellstoffresten durch Fermentationsverfahren unter Verwendung von Bakterien der Gattung erhalten werden Propionibacterium. Es wird auch aus Ethanol und Kohlenmonoxid unter Verwendung eines Bortrifluoridkatalysators erhalten (O'Neil, 2001)..
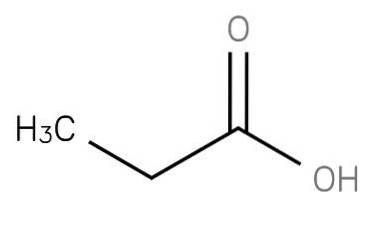
Ein anderer Weg, um Propansäure zu erhalten, ist die Oxidation von Propionaldehyd in Gegenwart von Kobalt- oder Manganionen. Diese Reaktion läuft bei Temperaturen von nur 40-50 ° C schnell ab:
2CH3CHzweiCHO + O.zwei → 2CH3CHzweiCOOH
Die Verbindung ist natürlich in geringen Mengen in Milchprodukten vorhanden und wird im Allgemeinen zusammen mit anderen kurzkettigen Fettsäuren im Magen-Darm-Trakt von Menschen und anderen Säugetieren als Endprodukt der mikrobiellen Kohlenhydratverdauung produziert..
Hat eine signifikante physiologische Aktivität bei Tieren (Human Metabolome Database, 2017).
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Biochemie
- 4 Verwendungen
- 5 Referenzen
Physikalische und chemische Eigenschaften
Propansäure ist eine farblose, ölige Flüssigkeit mit einem stechenden, unangenehmen, ranzigen Geruch. Sein Aussehen ist in Abbildung 2 dargestellt (Nationales Zentrum für Biotechnologie-Informationen, 2017)..

Propansäure hat ein Molekulargewicht von 74,08 g / mol und eine Dichte von 0,992 g / ml. Seine Gefrier- und Siedepunkte betragen -20,5 ° C bzw. 141,1 ° C. Propansäure ist eine schwache Säure mit einem pKa von 4,88.
Die Verbindung ist in Wasser sehr gut löslich und kann pro 100 ml Lösungsmittel 34,97 g Verbindung lösen. Es ist auch in Ethanol, Ether und Chloroform löslich (Royal Society of Chemistry, 2015).
Propansäure hat physikalische Eigenschaften, die zwischen denen der kleineren Carbonsäuren, Ameisensäure und Essigsäure und der größeren Fettsäuren liegen..
Es zeigt die allgemeinen Eigenschaften von Carbonsäuren und kann Amid-, Ester-, Anhydrid- und Chloridderivate bilden. Es kann in Gegenwart von PBr3 als Katalysator (der HVZ-Reaktion) eine Alpha-Halogenierung mit Brom eingehen, um CH3CHBrCOOH zu bilden.
Reaktivität und Gefahren
Propansäure ist ein brennbares und brennbares Material. Es kann durch Hitze, Funken oder Flammen entzündet werden. Dämpfe können mit Luft explosive Gemische bilden, die zur Zündquelle gelangen und explodieren können.
Die meisten Dämpfe sind schwerer als Luft. Sie werden über den Boden verteilt und in niedrigen oder engen Bereichen (Abwasserkanäle, Keller, Tanks) gesammelt. Dampfexplosionsgefahr in Innenräumen, im Freien oder in Abwasserkanälen.
Mit (P) gekennzeichnete Substanzen können beim Erhitzen oder Einschließen in ein Feuer explosionsartig polymerisieren. Behälter können beim Erhitzen explodieren (PROPIONIC ACID, 2016).
Die Verbindung sollte von Hitze oder Zündquellen ferngehalten werden. Wenn es zur Zersetzung erhitzt wird, gibt es scharfen Rauch und reizende Dämpfe ab.
Propansäure reizt Haut, Augen, Nase und Rachen, erzeugt jedoch keine akuten systemischen Wirkungen und weist kein nachweisbares genotoxisches Potenzial auf. Bei Kontakt mit viel Wasser waschen (Sicherheitsdatenblatt Propionsäure, 2013).
Biochemie
Die konjugierte Base von Propansäure, Propionat, wird als terminales Drei-Kohlenstoff-Fragment (aktiviert mit Coenzym A als Propionyl-CoA) bei der Oxidation von ungeradzahligen Kohlenstofffettsäuren und der Seitenkettenoxidation von Cholesterin gebildet.
Experimente mit radioaktiven Isotopen von Propionat, die in nüchterne Ratten injiziert wurden, zeigen, dass es in Glykogen, Glucose, Zwischenprodukten des Zitronensäurezyklus, Aminosäuren und Proteinen auftreten kann..
Der Weg des Propansäurestoffwechsels beinhaltet die Wechselwirkung mit Coenzym A, die Carboxylierung unter Bildung von Methylmalonyl-Coenzym A und die Umwandlung in Bernsteinsäure, die in den Zitronensäurezyklus eintritt.
Propansäure kann oxidiert werden, ohne Ketonkörper zu bilden, und im Gegensatz zu Essigsäure wird sie sowohl in ein Kohlenhydrat als auch in ein Lipid eingebaut (Bingham, Cohrssen & Powell, 2001)..
Propionsäureurie ist eine der häufigsten organischen Azidurien, eine Krankheit, die viele verschiedene Erkrankungen umfasst.
Das Ergebnis von Patienten, die mit Propionsäureurie geboren wurden, weist ein schlechtes intellektuelles Entwicklungsmuster auf. 60% haben einen IQ von weniger als 75 und benötigen eine spezielle Ausbildung.
Erfolgreiche Leber- und / oder Nierentransplantationen bei einigen Patienten haben zu einer verbesserten Lebensqualität geführt, jedoch nicht unbedingt Eingeweide und neurologische Komplikationen verhindert.
Diese Ergebnisse unterstreichen die Notwendigkeit einer permanenten Stoffwechselüberwachung unabhängig von der therapeutischen Strategie..
Anwendungen
Propansäure hemmt das Bakterien- und Schimmelwachstum in Mengen zwischen 0,1 und 1 Gew .-%. Infolgedessen wird der größte Teil der produzierten Propansäure als Konservierungsmittel sowohl für Futtermittel als auch für Lebensmittel für den menschlichen Verzehr wie Getreide und Getreide konsumiert..
Die Konservierung von Futtermitteln, Getreide und Lebensmitteln zusätzlich zur Produktion von Kalzium- und Natriumpropionaten, die 2016 fast 80% des weltweiten Propansäureverbrauchs ausmachen, verglichen mit 78,5% im Jahr 2012.
Ungefähr 51% des weltweiten Propansäureverbrauchs sind für Tierfutter und Getreidekonservierung bestimmt, während fast 29% für die Herstellung von Calcium- und Natriumpropionaten verwendet werden, die auch in der Lebensmittel- und Futtermittelindustrie verwendet werden.
Weitere wichtige Märkte für Propansäure sind die Produktion von Herbiziden und Diethylketonen. Anwendungen mit geringerem Volumen umfassen die Herstellung von Celluloseacetatpropionat, Pharmazeutika, Lösungsmittelestern, Aromastoffen und Duftstoffen, Weichmachern, Textil-, Leder- und Gummifarbstoffen und Hilfsstoffen.
Die Nachfrage nach Propansäure hängt stark von der Futter- und Getreideproduktion ab, gefolgt von verpackten Lebensmitteln und Backwaren.
Die globalen Wachstumsaussichten für Propansäure und ihre Salze in Tierfutter / Getreide und Lebensmittelkonservierung sind signifikant (IHS Markit, 2016)..
Andere schnell wachsende Märkte umfassen Propionatester für Lösungsmittel wie n-Butyl- und Pentylpropionat; Diese Ester werden zunehmend als Ersatz für Lösungsmittel verwendet, die als gefährliche Luftschadstoffe aufgeführt sind..
Verweise
- E. Bingham, B. Cohrssen & C. Powell (2001). Patty's Toxicology Volumes 1-9 5th ed. New York: John Wiley & Sons.
- EMBL-EBI. (2016, 14. Oktober). Propionsäure. Von ChEBI wiederhergestellt: ebi.ac.uk..
- Human Metabolome Database. (2017, 2. März). Propionsäure. Von hmdb.ca wiederhergestellt: hmdb.ca.
- IHS Markit. (2016, Dezember). Handbuch zur chemischen Ökonomie Propionsäure. Von ihs wiederhergestellt: ihs.com.
- Sicherheitsdatenblatt Propionsäure. (2013, 21. Mai). Von sciencelab wiederhergestellt: sciencelab.com.
- Nationales Zentrum für Informationen zur Biotechnologie… (2017, 22. April). PubChem Compound Database; CID = 1032. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- O'Neil, M. (. (2001). Der Merck-Index - Eine Enzyklopädie der Chemikalien, Arzneimittel und Biologika. 13. Auflage. New Jersey: Merck and Co., Inc..
- PROPIONSÄURE. (2016). Aus Cameochemikalien gewonnen: Cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). Propionsäure. Von chemspider wiederhergestellt: chemspider.com.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.