
Eigenschaften, Risiken und Verwendungen von Bromsäure (HBrO3)
Das Bromsäure, Auch als Bromatwasserstoff oder Bromsäure (V) bekannt, ist es eine chemische Verbindung mit der Formel HBrO3. Es ist eine Bromoxacid mit einer Struktur analog zu Chlorsäure (EMBL-EBI, 2014). Die Verbindung ist eine sehr starke Säure. Seine Struktur ist in Abbildung 1 dargestellt (EMBL-EBI, 2008)..
Zur Herstellung von Bromsäure wird üblicherweise ein lösliches Bromat in Wasser gelöst und ein lösliches Bariumsalz zugegeben. Schwerlösliches Bariumbromat fällt aus.
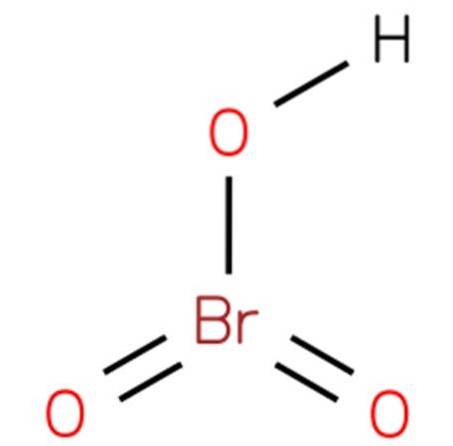
Das Bariumbromat kann dann in Wasser gelöst und mit Schwefelsäure angesäuert werden, um das im Wesentlichen unlösliche Bariumsulfat auszufällen und die Bromsäure zurückzulassen (siehe Bild oben):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO 3) 2 (aq) + H 2 SO 4 (aq) -> 2HBrO 3 + BaSO 4
Die Verbindung kann auch durch Zersetzung von Brompentachlorid in alkalischer Lösung gemäß der Reaktion hergestellt werden:
BrCl 5 + 3 H 2 O → HBrO 3 + 5 HCl
Bromsäure ist ein starkes Oxidationsmittel. Das Bromat kann mit elementarem Fluor oder Xenondifluorid in Gegenwart einer Base weiter oxidiert werden, Oxidation begleitet von kleinen Explosionen und das im Feuer gefangene Teflonrohr (My Favourite Chemicals, S.F.).
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Bromsäure
- 2 Reaktivität und Gefahren
- 2.1 Bei Kontakt mit den Augen
- 2.2 Bei Hautkontakt
- 2.3 Bei Inhalation
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften von Bromsäure
Bromsäure existiert nur in farbloser Lösung (bis zu 50% w / v), die bei Kontakt mit Luft gelblich wird (National Center for Biotechnology Information., 2017). Sein Aussehen ist in Abbildung 2 dargestellt.

Die Verbindung hat ein Molekulargewicht von 128,91 g / mol und zersetzt sich bei 100 ° C und hat einen pKa von -2. Da es sich um eine instabile Verbindung handelt, wurden ihre physikochemischen Eigenschaften durch rechnerische Berechnungen erhalten..
Es hat einen Schmelzpunkt von 206,04 ° C, einen Siedepunkt von 517,26 ° C und eine Wasserlöslichkeit von 1 x 106 mg / l bei 25 ° C (Royal Society of Chemistry, 2015)..
Die Verbindung ist ein starkes Oxidationsmittel. Wenn es mit Ethanol oder Ether gemischt wird, zersetzt es sich in einer exothermen Reaktion unter Bildung von Essigsäure. Es ist wichtig für die Herstellung von Bromatsalzen (BrO3-), die durch Umsetzung von Carbonaten oder Metalloxiden mit Bromsäure hergestellt werden (Watts, 1870)..
Reaktivität und Gefahren
Bromsäure ist eine instabile Verbindung, die sich zu elementarem Brom zersetzt. Als starke Säure ist sie bei Hautkontakt (ätzend und reizend), bei Augenkontakt (reizend) und bei Verschlucken äußerst gefährlich. Auch beim Einatmen sehr gefährlich.
Schwere Überbelichtung kann zu Lungenschäden, Erstickung, Bewusstlosigkeit oder zum Tod führen. Eine längere Exposition kann zu Hautverbrennungen und Geschwüren führen. Eine Überbelichtung durch Einatmen kann zu Reizungen der Atemwege führen..
Eine Entzündung des Auges ist durch Rötung, Bewässerung und Juckreiz gekennzeichnet. Eine Entzündung der Haut ist durch Juckreiz, Peeling, Rötung und gelegentliche Blasenbildung gekennzeichnet.
Die Substanz ist giftig für Nieren, Lunge und Schleimhäute. Wiederholter oder längerer Kontakt mit dem Stoff kann diese Organe schädigen..
Bei Kontakt mit den Augen
Überprüfen Sie, ob Kontaktlinsen getragen werden, und entfernen Sie diese sofort. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten. Kaltes Wasser kann verwendet werden. Augensalbe sollte nicht verwendet werden.
Bei Hautkontakt
Wenn die Chemikalie mit Kleidung in Kontakt kommt, entfernen Sie sie so schnell wie möglich, um Ihre eigenen Hände und Ihren Körper zu schützen. Stellen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie auf der exponierten Haut des Opfers ansammelt, z. B. auf den Händen, wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen. Kaltes Wasser kann verwendet werden. Bei anhaltender Reizung einen Arzt aufsuchen. Waschen Sie die kontaminierte Kleidung, bevor Sie sie erneut verwenden.
Bei starkem Hautkontakt sollte diese mit einer Desinfektionsseife gewaschen und die kontaminierte Haut mit einer antibakteriellen Creme abgedeckt werden..
Bei Inhalation
Es ist ratsam, das Opfer in einem gut belüfteten Bereich ruhen zu lassen. Wenn die Inhalation schwerwiegend ist, sollte das Opfer so bald wie möglich an einen sicheren Ort evakuiert werden. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte. Wenn das Opfer Schwierigkeiten beim Atmen hat, sollte Sauerstoff verabreicht werden.
Wenn das Opfer nicht atmet, wird eine Mund-zu-Mund-Beatmung durchgeführt. Denken Sie immer daran, dass es für die Person, die Hilfe leistet, gefährlich sein kann, eine Mund-zu-Mund-Beatmung durchzuführen, wenn das eingeatmete Material giftig, infektiös oder ätzend ist..
Bei Verschlucken kein Erbrechen herbeiführen. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatten. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch.
Suchen Sie in jedem Fall sofort einen Arzt auf..
Anwendungen
Bromsäure wird als starkes Oxidationsmittel in Laborreaktionen eingesetzt. Es wird verwendet, um chemische Verbindungen wie Iodate, Chlorsäure, Tetraihonsäure unter anderem herzustellen..
Es wird auch zur Herstellung von Bromat wie Eisen, Blei, Mangan und Quecksilberbromat verwendet..
Bromsäure fungiert als wichtiges Zwischenprodukt bei der Bélousov-Zhabotinsky-Reaktion (Morris, 2010). Diese Reaktion ist ein Beispiel für chemische Uhren und veranschaulicht eine thermodynamische Nichtgleichgewichtsreaktion.
Die Schwingungsreaktion wird durch Cer katalysiert und ist inhärent mit der Chemie der Bromoxosäuren HBrOx verbunden. Das wachsende Interesse an nichtlinearen chemischen Systemen hat starke Anreize für die Untersuchung der Chemie von Brom geschaffen..
Bei der Belousov-Zhabotinsky-Reaktion sind die beteiligten Bromverbindungen die hypobrome Säure HOBr, die Bromsäure HOBrO und die Bromsäure HBrO3 (3) (Rainer Glaser, 2013)..
Diese Arten von Reaktionen sind wichtig für die theoretische Chemie. Sie zeigen, dass chemische Reaktionen nicht vom thermodynamischen Gleichgewichtsverhalten dominiert werden müssen.
Verweise
- Bromsäure. (S.F.). Von chemyq.com wiederhergestellt.
- EMBL-EBI. (2008, 16. Mai). Bromsäure. Von ebi.ac.uk wiederhergestellt.
- EMBL-EBI. (2014, 28. Juli). Chlorsäure. Von ebi.ac.uk wiederhergestellt.
- Morris, S. (2010, 23. Januar). Belousov Zhabotinsky Reaktion 8 x normale Geschwindigkeit. Von youtubecom erholt.
- Meine Lieblingschemikalien. (S.F.). Von bromicacid.com wiederhergestellt.
- Nationales Zentrum für Informationen zur Biotechnologie. (2017, 11. März). PubChem Compound Database; CID = 24445,. Von PubChem abgerufen.
- Rainer Glaser, M. D. (2013). Warum die Säure von Bromsäure für kinetische Modelle von oszillierenden chemischen Reaktionen nach Belousov-Zhabotinsky wirklich wichtig ist. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Bromsäure. Von chemspider.com wiederhergestellt.
- Watts, H. (1870). Ein Wörterbuch der Chemie und verwandter Zweige anderer Wissenschaften, Band 1. London: Longmans, Green and Co..



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.