
Eigenschaften, Risiken und Verwendungen von Arsen (H3AsO3)
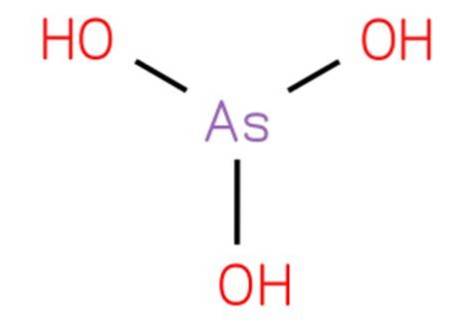
Das Arsen-Säure es ist eine anorganische Verbindung der Formel H3AsO3. Seine Struktur ist analog zu Trihydroxyamin und kann als As (OH) 3 umgeschrieben werden. Es liegt in wässriger Form vor und es war nicht möglich, es in einem reinen festen Zustand zu isolieren. Seine Struktur ist in Abbildung 1 dargestellt.
Die Herstellung von As (OH) 3 führt zu einer langsamen Hydrolyse von Arsentrioxid in Wasser. Die Summe der Base wandelt die Arsen-Säure in Arsenit-Ionen um: [AsO (OH) 2] -, [AsO2 (OH)] 2- und [AsO3] 3-.
Es ist eine schwache Säure. Reaktionen, die wässrigem Arsentrioxid zugeschrieben werden, sind auf Arsen und seine konjugierten Basen zurückzuführen.
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Arsen
- 2 Reaktivität und Gefahren
- 2.1 Bei Kontakt mit den Augen
- 2.2 Bei Hautkontakt
- 2.3 Bei Verschlucken
- 2.4 Bei Inhalation
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften von Arsen
Arsen-Säure ist ein Pyramidenmolekül, das aus drei an Arsen gebundenen Hydroxylgruppen besteht. Das 1H-NMR-Spektrum von Arsen-Säurelösungen besteht aus einem einzelnen Signal, das mit der hohen Symmetrie des Moleküls übereinstimmt. Existiert nur in wässriger Lösung.
Diese Lösung ist farblos und hat kein charakteristisches Aroma. Es wird in bernsteinfarbenen Behältern gelagert, um Reaktionen mit UV-Strahlung zu vermeiden (Nationales Zentrum für Biotechnologie-Informationen, 2017)..

Sein Molekulargewicht beträgt 125,94 g / mol. Obwohl die Verbindung nicht isoliert wurde, wurden ihre Eigenschaften unter Verwendung von Berechnungsmethoden berechnet (© Royal Society of Chemistry, 2015), wobei festgestellt wurde, dass sie einen Schmelzpunkt von 271,52 ° C, einen Siedepunkt von 626,14 ° C und eine Wasserlöslichkeit von 1 aufweist x 106 mg / l bei 25 ° C..
Die Verbindung hat einen pKa von 9,2 für die Reaktion:
H3AsO3 ⇌ H2AsO3- + H.+
Die Literatur berichtet, dass die Verbindung einen amphoteren Charakter hat, obwohl sie in geringerem Maße als Base dissoziiert als als Säure, wobei die Base einen pKb von 14 für die Reaktion aufweist:
As (OH) 3 ⇌ As (OH) 2+ + OH-
Dies führt zur Bildung von Spezies wie sauren Arsenhydroxidsulfaten (As (OH) (HSO4) +, As (OH) 2 (HSO4)) in konzentrierten Lösungen von Schwefelsäure oder zur Bildung von Arsen-Säuresulfat (As (HSO4) ) 3) in rauchenden Schwefelsäurelösungen.
Arsen kann als Oxidationsmittel oder Reduktionsmittel wirken und gemäß den Halbreaktionen als elementares Arsen bzw. Arsen verbleiben.
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0,240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Arsenhaltige Säure ist ein stärkeres Oxidationsmittel als ihr Phosphon-Gegenstück, aber ein schwächeres Reduktionsmittel als sie (Egon Wiberg, 2001)..
Reaktivität und Gefahren
Arsen ist eine als stabil eingestufte Verbindung, jedoch ein toxisches und ätzendes Reagenz.
Die Verbindung hat eine vernachlässigbare Brand- und Explosionsgefahr, wenn sie Hitze oder Flammen ausgesetzt wird. In diesem Fall sollte der Behälter nach Möglichkeit bewegt werden. Vermeiden Sie das Einatmen von Dämpfen oder Staub..
Beim Erhitzen setzt die Verbindung giftige und ätzende Arsenoxiddämpfe frei. Umluftunabhängiges Atemschutzgerät und Schutzkleidung sollten getragen werden, um einen Kontakt im Brandfall zu vermeiden.
Es kann Augen, Haut und Schleimhaut reizen. Kann Sensibilisierung verursachen. Eine Vergiftung kann das Zentralnervensystem, den Magen-Darm-Trakt und das Herz-Kreislauf-System, die Leber und die Nieren betreffen. Arsenhaltige Verbindungen sind hochtoxisch und krebserregend.
Bei Kontakt mit den Augen
Mindestens 15 Minuten lang mit viel Wasser waschen und gelegentlich die Augenlider anheben, bis keine chemischen Rückstände mehr erkennbar sind.
Bei Hautkontakt
Sofort mindestens 15 Minuten lang mit viel Wasser und Seife waschen, dabei kontaminierte Kleidung und Schuhe ausziehen. Verbrennungen werden mit einem trockenen sterilen Verband abgedeckt (sicher, nicht fest).
Bei Verschlucken
Dem bewussten Opfer sollten große Mengen Wasser gegeben werden, um die Säure zu verdünnen. Verwenden Sie keine Magenspülung und verursachen Sie kein Erbrechen. Das medizinische Personal muss die Atemwege und die Atmung aufrechterhalten.
Bei Inhalation
Bei Bedarf sollte künstlich beatmet werden. Bewegen Sie das Opfer an einen kühlen Ort und halten Sie es warm und in Ruhe.
In allen Fällen sollte sofort ein Arzt aufgesucht werden (Sicherheitsdatenblatt Arsenhaltige Säurelösung, 2007)..
Anwendungen
Arsenhaltige Säure wird verwendet, um kleine Mengen an Jod oder Jodverbindungen nachzuweisen. In der Arbeit von (Weegh, 1972) wurden einige Aspekte der Cerreaktion von Arsen untersucht, wobei die optischen Eigenschaften von Cerlösungen berücksichtigt wurden..
Die kinetischen Wirkungen verschiedener Verbindungen wurden ebenfalls untersucht, insbesondere die Wirkungen von Chlorid- und Bromidionen und die kinetischen Wirkungen von Chlorid oder Bromid in Kombination mit Iodid..
Arsen kann auch illegal verwendet werden, um Abtreibungen zu verursachen (Trend, 1858).
Arsen-Säure reagiert beim Erhitzen unter Bildung von Arsentrioxid (As2O3). Diese Verbindung ist auch allgemein unter dem Namen Arsen-Säure bekannt, obwohl sie nicht dieselbe Verbindung ist. Die Struktur von Arsentrioxid ist in Abbildung 3 dargestellt.
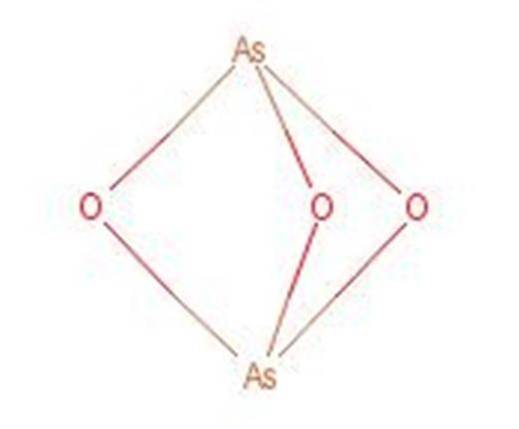
Abbildung 1: Struktur von Arsentrioxid.
Diese Verbindung, auch als Trisenox bekannt, wird zur Behandlung von Leukämiepatienten verwendet, die nicht auf andere Wirkstoffe angesprochen haben. Dieses Medikament ist für die Verwendung durch die US-amerikanische Food and Drug Administration (FDA) zur Behandlung von Leukämie zugelassen..
Wie die Verbindung funktioniert, ist unklar. Es kann morphologische Veränderungen und DNA-Fragmentierung in Promyelozyten-Leukämiezellen verursachen, was zum Zelltod und Abbau oder zur Schädigung von PML / RAR alpha (einem Fusionsprotein) führt (Nurse's Drug Handbook 7th Ed, 2013)..
Da es für den menschlichen Körper giftig ist, ist es eine der höchst umstrittenen Drogen auf diesem Gebiet. Arsentrioxid wurde zuerst als traditionelle chinesische Medizin namens Pi Shuang verwendet. Es wird noch heute zur Behandlung von Krebspatienten und anderen gesundheitlichen Problemen eingesetzt. (Arsenious Acid Review, 2007-2016).
Verweise
- © Royal Society of Chemistry. (2015). Arsenhaltige Säure. Von Chemspider erholt.
- © Royal Society of Chemistry. (2015). Trihydroxyamin. Von Chemspider erholt.
- Arsenious Säure Bewertung. (2007-2016). Von Medicalook erholt.
- Arsenhaltige Säure. (2014, 28. Juli). Von ebi.ac.uk wiederhergestellt.
- Egon Wiberg, N. W. (2001). Anorganische Chemie. Berlin: akademische Presse.
- Sicherheitsdatenblatt Arsenhaltige Säurelösung. (2007, 10. September). Von t3db.ca wiederhergestellt.
- Nationales Zentrum für Informationen zur Biotechnologie. (2017, 4. März). PubChem Compound Database; CID = 545 ,. Von PubChem abgerufen.
- Nurse's Drug Handbook, 7. Auflage (2013). McGraw-Hill.
- Trend, H. G. (1858). Ein Fall, in dem Arsen-Säure verwendet wurde, um Abtreibung zu beschaffen. Originalkommunikation des British Medical Journal, 725-726.
- Weegh, W. H. (1972). Verwendung der Cer-Arsen-Säure-Reaktion zur Bestimmung kleiner Mengen an Jod oder Jodverbindungen. Clinica Chimica Acta, Band 39, Ausgabe 2, 327-338.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.