
Struktur, Eigenschaften, Verwendungen und Risiken von Cyclopropan (C3H6)

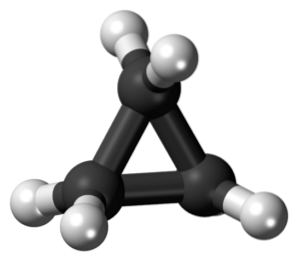
Das Cyclopropan ist ein cyclisches Molekül mit der Summenformel C.3H.6, und bestehend aus drei Kohlenstoffatomen, die in Form eines Rings miteinander verbunden sind. In der Chemie gibt es eine Familie gesättigter Kohlenwasserstoffe mit einem Gerüst aus Kohlenstoffatomen, die durch Einfachbindungen in Form eines Rings verbunden sind..
Diese Familie besteht aus einer unterschiedlichen Anzahl von Molekülen (die sich durch die Länge ihrer Hauptkohlenstoffkette unterscheiden) und hat bekanntermaßen höhere Schmelz- und Siedepunkte als die von hohen Ketten sowie eine größere Reaktivität als diese..
Cyclopropan wurde 1881 von einem österreichischen Chemiker namens August Freund entdeckt, der entschlossen war zu wissen, was das toxische Element in Ethylen ist, und der glaubte, es sei dasselbe Cyclopropan.
Trotzdem wurde es erst in den 1930er Jahren auf industrieller Ebene hergestellt, als sie seine Verwendung als Anästhesie entdeckten, weil sie es vor dieser Zeit nicht als kommerziell attraktiv empfanden.
Artikelverzeichnis
- 1 Chemische Struktur
- 2 Eigenschaften
- 2.1 Siedepunkt
- 2.2 Schmelzpunkt
- 2.3 Dichte
- 2.4 Reaktivität
- 3 Verwendungen
- 4 Risiken
- 5 Referenzen
Chemische Struktur
Cyclopropan der Summenformel C.3H.6, Es besteht aus drei kleinen Kohlenstoffatomen, die sich in einer Konfiguration verbinden, so dass ein Ring gebildet wird, der eine molekulare Symmetrie von D hinterlässt3h auf jedem Kohlenstoff in der Kette.
Die Struktur dieses Moleküls erfordert, dass die gebildeten Bindungswinkel etwa 60 ° betragen, viel weniger als die 109,5 °, die zwischen sp-Hybridatomen beobachtet werden.3, Das ist ein thermodynamisch stabilerer Winkel.
Dies führt dazu, dass der Ring zusätzlich zu einer natürlichen Torsionsspannung, die er aufgrund der verdeckten Konformation seiner Wasserstoffatome besitzt, unter einer größeren strukturellen Spannung als andere Strukturen dieses Typs leidet..
Aus dem gleichen Grund sind die Bindungen, die sich zwischen den Kohlenstoffatomen in diesem Molekül bilden, erheblich schwächer als in herkömmlichen Alkanen..
In besonderer Weise und im Gegensatz zu anderen Bindungen, bei denen die Nähe zwischen zwei Molekülen eine größere Bindungsenergie symbolisiert, haben die Bindungen zwischen den Kohlenstoffen dieses Moleküls die Besonderheit, dass sie (aufgrund ihrer Geometrie) eine kürzere Länge als die anderen Alkane haben und gleichzeitig Zeit sind sie schwächer als die Gewerkschaften zwischen diesen.
Darüber hinaus besitzt Cyclopropan die Stabilität durch zyklische Delokalisierung der sechs Elektronen in den Kohlenstoff-Kohlenstoff-Bindungen und ist etwas instabiler als Cyclobutan und erheblich höher als Cyclohexan..
Eigenschaften
Siedepunkt
Im Vergleich zu den anderen üblicheren Cycloalkanen hat Cyclopropan den niedrigsten Siedepunkt unter diesen Arten von Molekülen und verflüchtigt sich bei 33 Grad unter Null (keine anderen Cycloalkane verflüchtigen sich bei Temperaturen unter Null)..
Andererseits hat Cyclopropan im Vergleich zu linearem Propan einen höheren Siedepunkt: Es verflüchtigt sich bei 42 ° C unter Null, etwas niedriger als das seines Cycloalkan-Cousins.
Schmelzpunkt
Der Schmelzpunkt von Cyclopropan ist niedriger als der anderer Cycloalkane und schmilzt bei einer Temperatur von 128 ° C unter Null. Trotzdem ist es nicht das einzige Cycloalkan, das bei einer Temperatur unter Null schmilzt, und dieses Phänomen kann auch bei Cyclobutan, Cyclopentan und Cycloheptan beobachtet werden..
Im Fall von linearem Propan schmilzt es also bei einer Temperatur von weniger als 187 ° C unter Null..
Dichte
Cyclopropan hat die höchste Dichte unter den Cycloalkanen und ist mehr als doppelt so hoch wie das dichteste übliche Cycloalkan (1,879 g / l für Cyclopropan, das Cyclodecan mit 0,871 übertrifft)..
Eine höhere Dichte wird auch in Cyclopropan als in linearem Propan beobachtet. Der Unterschied in den Siede- und Schmelzpunkten zwischen linearen Alkanen und Cycloalkanen ist auf höhere Londoner Kräfte zurückzuführen, die durch die Ringform erhöht werden, die eine größere Kontaktfläche zwischen inneren Atomen ermöglicht..
Reaktivität
Die Reaktivität des Cyclopropanmoleküls wird direkt von der Schwäche seiner Bindungen beeinflusst, die im Vergleich zu anderen Cycloalkanen aufgrund des Einflusses der auf diese Bindungen ausgeübten Spannung erheblich zunimmt..
Dank dessen kann Cyclopropan leichter abgetrennt werden und kann sich bei bestimmten Reaktionen als Alken verhalten. Tatsächlich kann die extreme Reaktivität von Cyclopropan-Sauerstoff-Gemischen zu einer Explosionsgefahr werden..
Anwendungen
Die kommerzielle Verwendung von Cyclopropan schlechthin erfolgt als Anästhetikum, wobei diese Eigenschaft 1929 erstmals untersucht wurde.
Cyclopropan ist ein starkes, schnell wirkendes Anästhetikum, das die Atemwege nicht reizt oder einen schlechten Geruch hat. Es wurde mehrere Jahrzehnte zusammen mit Sauerstoff verwendet, um die Patienten während der Operation einzuschlafen, aber es wurden unerwünschte Nebenwirkungen beobachtet, die als "Cyclopropan-Schock" dargestellt wurden..
Zusammen mit den Kosten und den hohen Entflammbarkeitsfaktoren wurde ein Prozess des Verwerfens und Ersetzens durch andere sicherere Anästhetika durchlaufen..
Obwohl es weiterhin Teil der Verbindungen war, die bei der Einleitung der Anästhesie verwendet wurden, ist es heute nicht Teil der Mittel, die in medizinischen Anwendungen verwendet werden.
Risiken
- Cyclopropan ist ein leicht entzündliches Gas, das bei Kontakt mit einer Flamme giftige Gase erzeugt. Darüber hinaus kann es mit Oxidationsmitteln wie Perchloraten, Peroxiden, Permanganaten, Nitraten und Halogenen reagieren und Brände und / oder Explosionen verursachen..
- Hohe Cyclopropanwerte können Kopfschmerzen, Schwindel, Übelkeit, Koordinationsverlust, Ohnmacht und / oder Benommenheit verursachen..
- Es kann auch zu Herzrhythmusstörungen oder Herzrhythmusstörungen, Atembeschwerden, Koma und sogar zum Tod führen..
- Das verflüssigte Cyclopropan kann aufgrund seiner Temperatur erheblich unter Null Erfrierungen auf der Haut verursachen.
- Da es sich unter Umgebungsbedingungen um ein Gas handelt, kann diese Verbindung leicht über die Luft in den Körper gelangen und verringert auch den Sauerstoffgehalt in der Luft..
Verweise
- Britannica, E. (s.f.). Cyclopropan. Von britannica.com abgerufen
- Chemistry, O. (s.f.). Cyclopropansynthese. Von bio-chemistry.org wiederhergestellt
- ChemSpider. (s.f.). Cyclopropan. Von chemspider.com abgerufen
- Wagnières, O. (s.f.). Cyclopropan-haltige Naturstoffe. Von lspn.epfl.ch wiederhergestellt
- Wikipedia. (s.f.). Cyclopropan. Abgerufen von en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.