
Eigenschaften, Verwendungen, Strukturen, Risiken von Kaliumcyanid (KCN),
Das Kaliumcyanid ist eine anorganische Verbindung, die von einem Kalium-K-Ion gebildet wird+ und ein Cyanidion CN-. Seine chemische Formel lautet KCN. Es ist ein weißer kristalliner Feststoff, extrem giftig.
KCN ist in Wasser sehr gut löslich und hydrolysiert beim Auflösen unter Bildung von Blausäure oder HCN-Cyanwasserstoff, der ebenfalls sehr giftig ist. Kaliumcyanid kann mit Gold und Silber zusammengesetzte Salze bilden, weshalb es früher verwendet wurde, um diese Edelmetalle aus bestimmten Mineralien zu extrahieren..

KCN wird verwendet, um billige Metalle durch einen elektrochemischen Prozess mit Gold und Silber zu beschichten, dh ein Verfahren, bei dem elektrischer Strom durch eine Lösung geleitet wird, die ein Salz aus Edelmetall, Cyanid und Kalium enthält..
Kaliumcyanid muss, da es Cyanid enthält, mit geeigneten Geräten mit großer Sorgfalt behandelt werden. Es sollte niemals in die Umwelt gelangen, da es auch für die meisten Tiere und Pflanzen sehr giftig ist..
Es werden jedoch Methoden untersucht, bei denen gewöhnliche Algen verwendet werden, um Kaliumcyanid aus Wässern zu entfernen, die mit geringen Konzentrationen an Kaliumcyanid kontaminiert sind..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 3.8 Hydrolysekonstante
- 3.9 Chemische Eigenschaften
- 3.10 Andere Eigenschaften
- 4 Erhalten
- 5 Verwendung beim Galvanisieren von Metallen
- 5.1 Silber
- 5,2 Gold
- 5.3 Andere Verwendungen
- 6 Risiken
- 7 Wirkmechanismus
- 7.1 Zusätzliche Risiken
- 8 Aktuelle Studien
- 9 Referenzen
Struktur
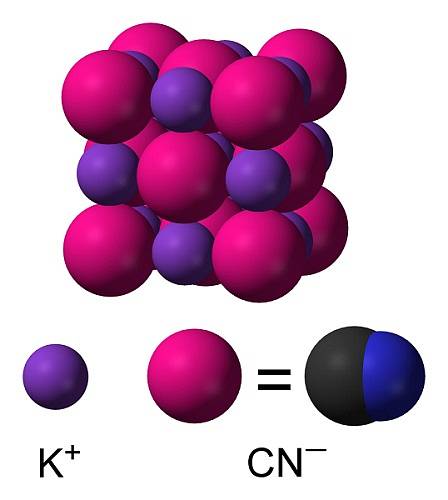
KCN ist eine ionische Verbindung, die durch ein Kalium-K-Kation gebildet wird+ und ein Cyanidanion CN-. Dabei ist das Kohlenstoffatom durch eine dreifache kovalente Bindung mit dem Stickstoffatom verbunden..

In festem Kaliumcyanid das CN-Anion- Es kann sich frei drehen, so dass es sich wie ein kugelförmiges Anion verhält. Infolgedessen hat der KCN-Kristall eine kubische Struktur ähnlich der von Kaliumchlorid KCl.
Nomenklatur
- Kaliumcyanid
- Kaliumcyanid
- Cyanopotassium
Eigenschaften
Körperlicher Status
Weißer kristalliner Feststoff. Kubische Kristalle.
Molekulargewicht
65,116 g / mol.
Schmelzpunkt
634,5 ° C.
Siedepunkt
1625 ° C..
Dichte
1,55 g / cm3 bei 20 ° C..
Löslichkeit
In Wasser sehr gut löslich: 716 g / l bei 25 ° C und 100 g / 100 ml Wasser bei 80 ° C. In Methanol schwer löslich: 4,91 g / 100 g Methanol bei 19,5 ° C. In Ethanol sehr schwer löslich: 0,57 g / 100 g Ethanol bei 19,5 ° C..
pH
Eine wässrige Lösung von 6,5 g KCN in 1 l Wasser hat einen pH-Wert von 11,0.
Hydrolysekonstante
KCN ist in Wasser sehr gut löslich. Wenn es sich auflöst, ist das Cyanidion CN frei- welches ein Proton H nimmt+ von Wasser unter Bildung von Blausäure HCN und Freisetzung eines OH-Ions-::
CN- + H.zweiO → HCN + OH-
Die Hydrolysekonstante gibt die Tendenz an, mit der die Reaktion durchgeführt wird.
K.h = 2,54 x 10-5
Wässrige KCN-Lösungen setzen beim Erhitzen über 80 ° C HCN-Cyanwasserstoff in die Umgebung frei.
Chemische Eigenschaften
Es ist nicht brennbar, aber wenn festes KCN zur Zersetzung erhitzt wird, gibt es sehr giftige Gase von Cyanwasserstoff HCN, Stickoxiden NO, abx, Kaliumoxid K.zweiO und Kohlenmonoxid CO.
KCN reagiert mit Goldsalzen unter Bildung von Kaliumaurocyanid KAu (CN)zwei und Kaliumatrium KAu (CN)4. Dies sind farblose Komplexsalze. KCN bildet mit dem Silbermetall Ag das Kaliumargentocyanid KAg (CN)zwei.
Das Cyanidion von KCN reagiert mit bestimmten organischen Verbindungen, die Halogene (wie Chlor oder Brom) enthalten, und tritt an ihre Stelle. Beispielsweise reagiert es mit Bromessigsäure zu Cyanessigsäure..
Andere Eigenschaften
Es ist hygroskopisch, nimmt Feuchtigkeit aus der Umgebung auf.
Es hat einen milden bitteren Mandelgeruch, der jedoch nicht von allen Menschen wahrgenommen wird.
Erhalten
KCN wird hergestellt, indem Kaliumhydroxid KOH in wässriger Lösung mit Cyanwasserstoff HCN umgesetzt wird. Es wird auch durch Erhitzen von Kaliumferrocyanid K erhalten4Glaube (CN)6::
K.4Glaube (CN)6 → 4 KCN + 2 C + N.zwei↑ + Glaube
Verwendung beim Galvanisieren von Metallen
Es wird bei der Beschichtung von Metallen mit geringem Wert mit Gold und Silber verwendet. Es ist ein elektrolytischer Prozess, dh Elektrizität wird durch eine wässrige Lösung mit geeigneten Salzen geleitet.
Silber
Kaliumargentocyanid KAg (CN) wird verwendetzwei für Silberbeschichtung (Ag) billigere Metalle.
Diese werden in eine wässrige Lösung von Kaliumargentocyanid KAg (CN) gegeben.zwei, Dabei ist die Anode oder der positive Pol ein Balken aus reinem Silber (Ag) und die Kathode oder der negative Pol das billige Metall, das Sie mit Silber beschichten möchten.
Während ein elektrischer Strom durch die Lösung fließt, wird das Silber auf dem anderen Metall abgeschieden. Bei Verwendung von Cyanidsalzen wird die Silberschicht feiner, kompakter und haftender abgeschieden als in Lösungen anderer Verbindungen..

Gold
Ähnliches gilt für Gold (Au), Kaliumaurocyanid KAu (CN)zwei und Kaliumatrium KAu (CN)4 werden verwendet, um andere Metalle elektrolytisch zu vergolden.

Andere Verwendungen
Hier sind einige andere Verwendungen von Kaliumcyanid.
- Für den industriellen Prozess des Härtens von Stahl durch Nitrieren (Zugabe von Stickstoff).
- Zur Metallreinigung.
- In Druck- und Fotoprozessen.
- Früher wurde es zur Gewinnung von Gold und Silber aus den Mineralien verwendet, die es enthalten, später wurde es durch Natriumcyanid-NaCN ersetzt, das weniger teuer, aber gleichermaßen giftig ist.
- Als Insektizid zum Besprühen von Bäumen, Schiffen, Eisenbahnwaggons und Lagerhäusern.
- Als Reagenz in der analytischen Chemie, dh zur chemischen Analyse.
- Zur Herstellung anderer chemischer Verbindungen wie Farbstoffe und Farbstoffe.

Risiken
KCN ist eine sehr giftige Verbindung für Tiere und die meisten Pflanzen und Mikroorganismen. Es ist als super giftig eingestuft. Es ist schon in sehr geringen Mengen tödlich.
Seine schädliche Wirkung kann durch Einatmen, Kontakt mit Haut oder Augen oder Verschlucken auftreten. Hemmt viele Stoffwechselprozesse, insbesondere Blutproteine, die am Sauerstofftransport beteiligt sind, wie Hämoglobin.
Es betrifft die Organe oder Systeme, die am empfindlichsten für Sauerstoffmangel sind, wie das Zentralnervensystem (Gehirn), das Herz-Kreislauf-System (Herz und Blutgefäße) und die Lunge.

Wirkmechanismus
KCN beeinträchtigt die Fähigkeit des Körpers, Sauerstoff zu verbrauchen.
Das Cyanidion CN- KCN hat eine hohe Affinität zum Eisen (III) -Ion Fe3+, Das heißt, wenn Cyanid absorbiert wird, reagiert es schnell mit Fe3+ von Blut und Geweben.
Auf diese Weise wird verhindert, dass die Zellen atmen, was zu einem Sauerstoffmangel führt, denn obwohl sie versuchen zu atmen, können sie ihn nicht verwenden..
Dann gibt es einen vorübergehenden Zustand von Hyperapnoe (Unterbrechung der Atmung) und Kopfschmerzen und schließlich den Tod aufgrund eines Atemstillstands..
Zusätzliche Risiken
Beim Erhitzen entstehen sehr giftige Gase wie HCN, Stickoxide NOx, Kaliumoxid K.zweiO und Kohlenmonoxid CO.
Wenn es mit Feuchtigkeit in Kontakt kommt, setzt es HCN frei, das leicht entflammbar und sehr giftig ist..
KCN ist auch für Wasserorganismen sehr giftig. Es sollte niemals in die Umwelt entsorgt werden, da es zu einer Kontamination von Gewässern kommen kann, in denen Tiere trinken und Fische leben.
Es gibt jedoch Bakterien, die Cyanid produzieren, wie z Chromobacterium violaceum und einige Arten von Pseudomonas.
Aktuelle Studien
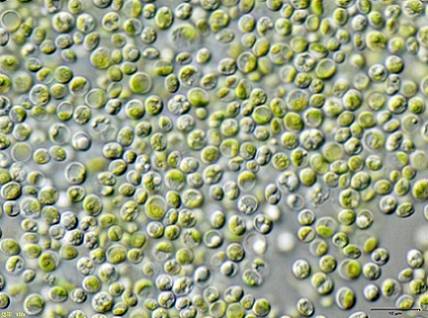
Bestimmte Forscher fanden, dass Grünalgen Chlorella vulgaris kann verwendet werden, um mit KCN-Kaliumcyanid kontaminiertes Wasser in geringen Konzentrationen zu behandeln.
Die Algen konnten das KCN effizient entfernen, da dies in geringen Mengen das Wachstum der Algen stimulierte, da es einen internen Mechanismus aktivierte, um der Toxizität des KCN zu widerstehen.
Dies bedeutet, dass die Alge Chlorella vulgaris hat das Potenzial, Cyanid zu entfernen, und dass damit ein wirksames Verfahren zur biologischen Behandlung von Cyanidkontaminationen entwickelt werden könnte.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Kaliumcyanid. Nationales Zentrum für Informationen zur Biotechnologie. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Coppock, R.W. (2009). Bedrohung der Tierwelt durch chemische Kampfstoffe. Im Handbuch der Toxikologie chemischer Kampfstoffe. Von sciencedirect.com wiederhergestellt.
- Liu, Q. (2017). Bewertung der Entfernung von Kaliumcyanid und seiner Toxizität in Grünalgen (Chlorella vulgaris). Bull Environ Contam Toxicol. 2018; 100 (2): 228 & ndash; 233. Von ncbi.nlm.nih.gov wiederhergestellt.
- Das Nationale Institut für Sicherheit und Gesundheitsschutz am Arbeitsplatz (NIOSH). (2011). Kaliumcyanid: Systemisches Mittel. Von cdc.gov wiederhergestellt.
- Alvarado, L.J. et al. (2014). Riboswitch Discovery, Struktur und Funktion. Synthese von Uracil. In Methoden der Enzymologie. Von sciencedirect.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.