
Struktur, Eigenschaften und Verwendung von Silberbromid (AgBr)
Das Silberbromid Es ist ein anorganisches Salz, dessen chemische Formel AgBr ist. Sein Feststoff besteht aus Kationen Ag+ und Br anionen- im Verhältnis 1: 1, angezogen von elektrostatischen Kräften oder Ionenbindungen. Es ist zu sehen, als hätte metallisches Silber molekularem Brom eines seiner Valenzelektronen gegeben.
Seine Natur ähnelt seinen "Geschwistern" Silberchlorid und Jodid. Alle drei Salze sind wasserunlöslich, haben ähnliche Farben und sind auch lichtempfindlich; das heißt, sie unterliegen photochemischen Reaktionen. Diese Eigenschaft wurde aufgrund der Reduktion von Ag-Ionen zum Erhalten von Fotografien verwendet+ zu metallischem Silber.
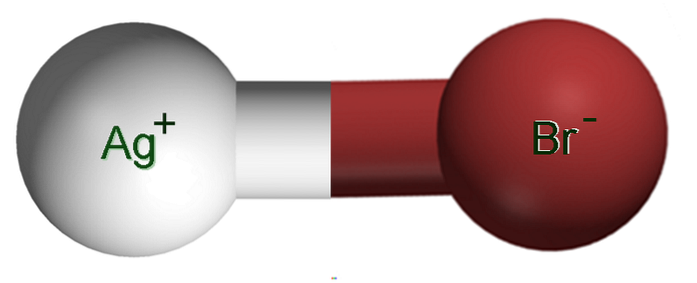
Das Bild oben zeigt ein Ionenpaar Ag+Br-, in denen die weißen und braunen Kugeln Ag-Ionen entsprechen+ und Br-, beziehungsweise. Hier stellen sie die Ionenbindung als Ag-Br dar, es muss jedoch angegeben werden, dass zwischen beiden Ionen keine solche kovalente Bindung besteht.
Es mag widersprüchlich erscheinen, dass Silber die schwarze Farbe zu Fotografien ohne Farbe beiträgt. Dies liegt daran, dass das AgBr mit Licht reagiert und ein latentes Bild erzeugt. was dann durch Erhöhen der Reduktion von Silber verstärkt wird.
Artikelverzeichnis
- 1 Struktur von Silberbromid
- 1.1 Kristallfehler
- 2 Synthese
- 3 Eigenschaften
- 3.1 Aussehen
- 3.2 Molekularmasse
- 3.3 Dichte
- 3.4 Schmelzpunkt
- 3.5 Siedepunkt
- 3.6 Löslichkeit in Wasser
- 3.7 Brechungsindex
- 3.8 Wärmekapazität
- 3.9 Lichtempfindlichkeit
- 4 Verwendungen
- 5 Referenzen
Struktur von Silberbromid
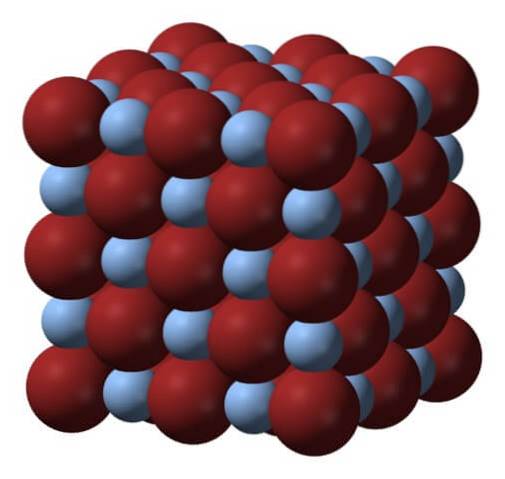
Oben ist die Gitter- oder Kristallstruktur von Silberbromid dargestellt. Hier ist eine genauere Darstellung des Größenunterschieds zwischen den Ionenradien von Ag+ und Br-. Br Anionen-, voluminöser lassen sie Zwischenräume, in denen sich die Ag-Kationen befinden+, welches von sechs Br umgeben ist- (und umgekehrt).
Diese Struktur ist charakteristisch für ein kubisches kristallines System, insbesondere vom Steinsalztyp; das gleiche zum Beispiel wie für Natriumchlorid, NaCl. Tatsächlich erleichtert das Bild dies, indem es eine perfekte kubische Grenze anordnet.
Auf den ersten Blick ist zu erkennen, dass zwischen den Ionen ein gewisser Größenunterschied besteht. Dies und vielleicht die elektronischen Eigenschaften der Ag+ (und die mögliche Wirkung einiger Verunreinigungen) führt dazu, dass AgBr-Kristalle Defekte aufweisen; das heißt, Orte, an denen die Ordnungssequenz von Ionen im Raum "gebrochen" ist.
Kristalldefekte
Diese Defekte bestehen aus Hohlräumen, die durch fehlende oder verdrängte Ionen zurückbleiben. Zum Beispiel zwischen sechs Br-Anionen- normalerweise sollte das Kation Ag sein+;; Stattdessen kann es zu einer Lücke kommen, weil sich das Silber in eine andere Lücke bewegt hat (Frenkel-Defekt)..
Obwohl sie das Kristallgitter beeinflussen, begünstigen sie die Reaktionen von Silber mit Licht; und je größer die Kristalle oder ihr Cluster (Größe der Körner) sind, desto größer ist die Anzahl der Defekte, und daher ist es lichtempfindlicher. Ebenso beeinflussen Verunreinigungen die Struktur und diese Eigenschaft, insbesondere solche, die mit Elektronen reduziert werden können..
Infolgedessen erfordern große AgBr-Kristalle eine geringere Belichtung, um sie zu reduzieren. das heißt, sie sind für fotografische Zwecke wünschenswerter.
Synthese
Im Labor kann Silberbromid durch Mischen einer wässrigen Lösung von Silbernitrat, AgNO, synthetisiert werden3, mit dem Salz von Natriumbromid, NaBr. Das erste Salz trägt das Silber und das zweite das Bromid bei. Was folgt, ist eine Doppelverschiebungs- oder Metathesereaktion, die durch die folgende chemische Gleichung dargestellt werden kann:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Beachten Sie, dass das Natriumnitrat-Salz NaNO3, es ist wasserlöslich, während AgBr als Feststoff mit einer schwachen gelben Farbe ausfällt. Anschließend wird der Feststoff gewaschen und einer Vakuumtrocknung unterzogen. Neben NaBr könnte KBr auch als Quelle für Bromidanionen verwendet werden.
Andererseits kann AgBr natürlich durch sein Mineral Bromirit und seine ordnungsgemäßen Reinigungsprozesse erhalten werden..
Eigenschaften
Aussehen
Tonartiger, weißlich-gelber Feststoff.
Molekulare Masse
187,77 g / mol.
Dichte
6,473 g / ml.
Schmelzpunkt
432 ° C..
Siedepunkt
1502 ° C..
Wasserlöslichkeit
0,140 g / ml bei 20 ° C..
Brechungsindex
2,253.
Wärmekapazität
270 J / kg K..
Lichtempfindlichkeit
Im vorherigen Abschnitt wurde gesagt, dass es Defekte in AgBr-Kristallen gibt, die die Lichtempfindlichkeit dieses Salzes fördern, da sie die gebildeten Elektronen einfangen; und somit wird theoretisch verhindert, dass sie mit anderen Arten in der Umwelt reagieren, wie z. B. Luftsauerstoff.
Das Elektron wird aus der Br-Reaktion freigesetzt- mit einem Photon:
Br- + hv => 1 / 2Brzwei + und-
Beachten Sie, dass Br produziert wirdzwei, Dies färbt das feste Rot, wenn es nicht entfernt wird. Freisetzte Elektronen reduzieren Ag-Kationen+, in seinen Zwischenräumen zu metallischem Silber (manchmal dargestellt als Ag0):
Ag+ + und- => Ag
Mit dann die Netzgleichung:
AgBr => Ag + 1 / 2Brzwei
Wenn sich die "ersten Schichten" aus metallischem Silber auf der Oberfläche bilden, wird gesagt, dass es ein latentes Bild gibt, das für das menschliche Auge immer noch unsichtbar ist. Dieses Bild wird millionenfach sichtbarer, wenn eine andere chemische Spezies (wie Hydrochinon und Phenidon im Entwicklungsprozess) die Reduktion der AgBr-Kristalle zu metallischem Silber erhöht.
Anwendungen

Silberbromid ist das am weitesten verbreitete seiner Halogenide auf dem Gebiet der fotografischen Filmentwicklung. AgBr wird auf die Filme aufgebracht, die mit Celluloseacetat hergestellt, in Gelatine (fotografische Emulsion) und in Gegenwart von 4- (Methylamino) phenolsulfat (Metol) oder Phenidon und Hydrochinon suspendiert sind.
Mit all diesen Reagenzien kann das latente Bild zum Leben erweckt werden; Beenden und beschleunigen Sie die Umwandlung von ionischem zu metallischem Silber. Wenn Sie jedoch nicht mit einiger Sorgfalt und Erfahrung vorgehen, oxidiert das gesamte Silber auf der Oberfläche und der Kontrast zwischen den Farben Schwarz und Weiß endet..
Aus diesem Grund sind die Schritte zum Anhalten, Fixieren und Eintauchen in fotografische Filme von entscheidender Bedeutung..
Es gibt Künstler, die mit diesen Prozessen so spielen, dass sie Graustufen erzeugen, die die Schönheit des Bildes und ihr eigenes Erbe bereichern. und sie tun dies alles, manchmal vielleicht ohne es zu ahnen, dank chemischer Reaktionen, deren theoretische Grundlage etwas komplex werden kann, und eines lichtempfindlichen AgBr, das einen Ausgangspunkt markiert.
Verweise
- Wikipedia. (2019). Silberbromid. Wiederhergestellt von: en.wikipedia.org
- Michael W. Davidson. (2015, 13. November). Digitale Bildergalerie für polarisiertes Licht: Silberbromid. Olymp. Wiederhergestellt von: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Silberbromid (AgBr). Wiederhergestellt von: crystran.co.uk
- Lothar Duenkel, Jürgen Eichler, Gerhard Ackermann und Claudia Schneeweiss. (29. Juni 2004). Selbst hergestellte Emulsionen auf Silberbromidbasis für Anwender in der Holographie: Herstellung, Verarbeitung und Anwendung, Proc. SPIE 5290, Praktische Holographie XVIII: Materialien und Anwendungen; doi: 10.1117 / 12.525035; https://doi.org/10.1117/12.525035
- Alan G. Shape. (1993). Anorganische Chemie. (Zweite Ausgabe.). Editorial Reverté.
- Carlos Güido und Ma Eugenia Bautista. (2018). Einführung in die fotografische Chemie. Wiederhergestellt von: fotografia.ceduc.com.mx
- García D. Bello. (9. Januar 2014). Chemie, Fotografie und Chema Madoz. Wiedergewonnen aus: Dimethylsulfuro.es



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.