
Effektives Kernladungskonzept, Berechnungsmethode und Beispiele
Das effektive nukleare Ladung (Zef) ist die Anziehungskraft, die der Kern auf eines der Elektronen ausübt, nachdem er durch die Auswirkungen von Abschirmung und Penetration verringert wurde. Wenn es keine solchen Effekte gäbe, würden die Elektronen die Anziehungskraft der realen Kernladung Z spüren.
Im Bild unten haben wir das Bohr-Atommodell für ein fiktives Atom. Sein Kern hat eine Kernladung Z = + n, die die Elektronen anzieht, die ihn umkreisen (die blauen Kreise). Es ist ersichtlich, dass sich zwei Elektronen in einer Umlaufbahn befinden, die näher am Kern liegt, während das dritte Elektron in größerer Entfernung davon liegt..
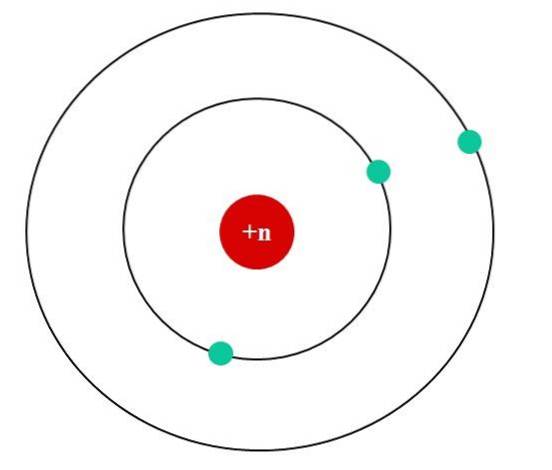
Das dritte Elektron umkreist die elektrostatischen Abstoßungen der beiden anderen Elektronen, so dass der Kern sie mit weniger Kraft anzieht. das heißt, die Kern-Elektronen-Wechselwirkung nimmt infolge der Abschirmung der ersten beiden Elektronen ab.
Die ersten beiden Elektronen spüren also die Anziehungskraft einer + n-Ladung, während die dritte stattdessen eine effektive Kernladung von + (n-2) erfährt..
Dieser Zef wäre jedoch nur gültig, wenn die Abstände (der Radius) zum Kern aller Elektronen immer konstant und eindeutig wären und ihre negativen Ladungen (-1) lokalisieren würden..
Artikelverzeichnis
- 1 Konzept
- 1.1 Durchdringungs- und Abschirmeffekte
- 2 Wie berechnet man es??
- 2.1 Slaters Regel
- 3 Beispiele
- 3.1 Bestimmen Sie Zef für Elektronen im 2s2-Orbital in Beryllium
- 3.2 Bestimmen Sie Zef für die Elektronen im 3p3-Orbital des Leuchtstoffs
- 4 Referenzen
Konzept
Protonen definieren die Kerne chemischer Elemente, und Elektronen definieren ihre Identität innerhalb einer Reihe von Merkmalen (die Gruppen des Periodensystems)..
Protonen erhöhen die Kernladung Z mit einer Geschwindigkeit von n + 1, die durch die Zugabe eines neuen Elektrons zur Stabilisierung des Atoms kompensiert wird.
Mit zunehmender Anzahl von Protonen wird der Kern von einer dynamischen Elektronenwolke „bedeckt“, in der die Regionen, durch die sie zirkulieren, durch die Wahrscheinlichkeitsverteilungen der radialen und eckigen Teile der Wellenfunktionen (der Orbitale) definiert werden..
Bei diesem Ansatz kreisen die Elektronen nicht in einem definierten Raumbereich um den Kern herum, sondern verschwimmen wie die Flügel eines schnell rotierenden Fächers in die Formen der bekannten Orbitale s, p, d und f.
Aus diesem Grund wird die negative Ladung -1 eines Elektrons durch die Bereiche verteilt, in die die Orbitale eindringen. Je größer der Penetrationseffekt ist, desto größer ist die effektive Kernladung, die das Elektron im Orbital erfahren wird.
Penetrations- und Abschirmeffekte
Gemäß der obigen Erklärung tragen die Elektronen in den inneren Schalen keine -1-Ladung zur stabilisierenden Abstoßung der Elektronen in den äußeren Schalen bei..
Dieser Kern (die zuvor mit Elektronen gefüllten Schalen) dient jedoch als "Wand", die verhindert, dass die Anziehungskraft des Kerns die äußeren Elektronen erreicht..
Dies wird als Bildschirmeffekt oder Abschirmeffekt bezeichnet. Auch erfahren nicht alle Elektronen in den Außenschalen die gleiche Stärke dieses Effekts; Wenn Sie beispielsweise ein Orbital besetzen, das einen hohen durchdringenden Charakter hat (dh sehr nahe am Kern und anderen Orbitalen verläuft), spüren Sie einen höheren Zef.
Infolgedessen ergibt sich eine Funktion der energetischen Stabilität als Funktion dieses Zef für die Orbitale: s Dies bedeutet, dass das 2p-Orbital eine höhere Energie hat (weniger stabilisiert durch die Ladung des Kerns) als das 2s-Orbital.. Je schlechter der vom Orbital ausgeübte Penetrationseffekt ist, desto geringer ist seine Abschirmwirkung auf den Rest der externen Elektronen. Die d- und f-Orbitale zeigen viele Löcher (Knoten), in denen der Kern andere Elektronen anzieht. Unter der Annahme, dass die negativen Ladungen lokalisiert sind, lautet die Formel zur Berechnung des Zef für jedes Elektron: Zef = Z - σ In dieser Formel ist σ die Abschirmkonstante, die durch die Elektronen des Kerns bestimmt wird. Dies liegt daran, dass theoretisch die äußersten Elektronen nicht zur Abschirmung der inneren Elektronen beitragen. Mit anderen Worten, 1szwei Schildelektron 2s1, aber 2s1 schirmt Z-Elektronen 1s nicht abzwei. Wenn Z = 40 ist und die genannten Effekte vernachlässigt werden, erfährt das letzte Elektron einen Zef von 1 (40-39).. Die Slater-Regel ist eine gute Annäherung an die Zef-Werte für die Elektronen im Atom. Führen Sie die folgenden Schritte aus, um es anzuwenden: 1- Die elektronische Konfiguration des Atoms (oder Ions) sollte wie folgt geschrieben werden: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f)… 2- Die Elektronen rechts von dem betrachteten tragen nicht zum Abschirmeffekt bei. 3- Die Elektronen, die sich innerhalb derselben Gruppe befinden (durch die Klammern gekennzeichnet), liefern 0,35 die Ladung des Elektrons, es sei denn, es ist die 1s-Gruppe, stattdessen 0,30. 4- Wenn das Elektron ein s- oder p-Orbital besetzt, tragen alle n-1-Orbitale 0,85 und alle n-2-Orbitale eine Einheit bei. 5- Wenn das Elektron ein d- oder f-Orbital einnimmt, tragen alle links davon eine Einheit bei. Nach Slaters Darstellungsweise lautet die elektronische Konfiguration von Be (Z = 4): (1szwei) (2szwei2 P.0) Da sich im Orbital zwei Elektronen befinden, trägt eines davon zur Abschirmung des anderen bei, und das 1s-Orbital ist das n-1 des 2s-Orbitals. Wenn wir dann die algebraische Summe entwickeln, haben wir Folgendes: (0,35) (1) + (0,85) (2) = 2,05 Die 0,35 stammten vom 2s-Elektron und die 0,85 von den beiden 1s-Elektronen. Wenden wir nun die Formel von Zef an: Zef = 4 - 2,05 = 1,95 Was bedeutet das? Dies bedeutet, dass die Elektronen im 2s-Orbital sindzwei Erlebe eine Ladung von +1,95, die sie zum Kern zieht, anstatt zur tatsächlichen Ladung von +4. Wieder geht es weiter wie im vorherigen Beispiel: (1szwei) (2szwei2 P.6) (3szwei3p3) Nun wird die algebraische Summe entwickelt, um σ zu bestimmen: (, 35) (4) + (0,85) (8) + (1) (2) = 10,2 Zef ist also der Unterschied zwischen σ und Z: Zef = 15-10,2 = 4,8 Abschließend die letzten 3p Elektronen3 Sie haben eine dreimal geringere Belastung als die reale. Es ist auch zu beachten, dass nach dieser Regel die 3s-Elektronenzwei Erleben Sie den gleichen Zef, ein Ergebnis, das Zweifel aufkommen lassen könnte. Es gibt jedoch Änderungen der Slater-Regel, die dazu beitragen, die berechneten Werte der tatsächlichen Werte zu approximieren..Wie man es berechnet?
Slaters Regel
Beispiele
Bestimmen Sie Zef für die Elektronen im 2s-Orbitalzwei in Beryllium
Bestimmen Sie Zef für die Elektronen im 3p-Orbital3 von Phosphor
Verweise


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.