
Valencia Schicht, woraus es besteht, Beispiele
Das Kap von Valencia Es ist eines, dessen Elektronen für die chemischen Eigenschaften eines Elements verantwortlich sind. Die Elektronen in dieser Hülle interagieren mit denen eines benachbarten Atoms und bilden so kovalente Bindungen (A-B). und wenn sie von einem Atom zu einem anderen wandern, sind die elektronegativen Ionenbindungen (A + B-).
Diese Schicht wird durch die Hauptquantenzahl definiert n, Dies gibt wiederum den Zeitraum an, in dem sich das Element im Periodensystem befindet. Während die Gruppenreihenfolge von der Anzahl der Elektronen abhängt, die in der Valenzschale umkreisen. Also für eine n gleich 2 kann es acht Elektronen besetzen: acht Gruppen (1-8).
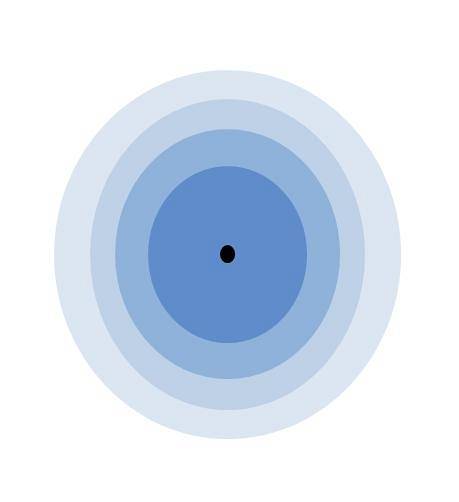
Das obige Bild zeigt die Bedeutung der Valenzschicht. Der schwarze Punkt in der Mitte des Atoms ist der Kern, während die verbleibenden konzentrischen Kreise die durch definierten elektronischen Schalen sind n.
Wie viele Schichten hat dieses Atom? Jeder von ihnen hat seine eigene Farbe, und da es vier gibt, hat das Atom vier Schichten (n= 4). Beachten Sie auch, dass sich die Farbe mit zunehmendem Abstand von der Schicht zum Kern verschlechtert. Die Valenzschicht ist diejenige, die am weitesten vom Kern entfernt ist: die mit der hellsten Farbe.
Artikelverzeichnis
- 1 Was ist die Valenzschicht??
- 2 Funktionen
- 3 Beispiele
- 3.1 Beispiel 1
- 3.2 Beispiel 2
- 4 Referenzen
Was ist die Valenzschicht?
Dem Bild zufolge ist die Valenzschale nichts anderes als die letzten Orbitale eines Atoms, das von Elektronen besetzt ist. Im hellblauen Umhang zu n= 4 gibt es eine Reihe von 4s-, 4p-, 4d- und 4f-Orbitalen; Das heißt, im Inneren befinden sich andere Unterschichten mit unterschiedlichen elektronischen Fähigkeiten.
Ein Atom benötigt Elektronen, um alle 4n-Orbitale zu füllen. Dieser Prozess kann in den elektronischen Konfigurationen der Elemente über einen Zeitraum beobachtet werden.
Beispielsweise hat Kalium eine [Ar] 4s-Elektronenkonfiguration1, während Kalzium zu seiner Rechten [Ar] 4szwei. Was ist nach diesen Einstellungen die Valenzschicht? Der Begriff [Ar] bezieht sich auf die elektronische Konfiguration des Edelgases Argon 1szwei2szwei2 P.63szwei3p6. Dies stellt die innere oder geschlossene Schicht dar (auch bekannt als Kernel).
Da das 4s-Orbital dasjenige mit der höchsten Energie ist und in das die neuen Elektronen eintreten, stellt es die Valenzschale sowohl für K als auch für Ca dar. Wenn die K- und Ca-Atome mit dem im Bild verglichen würden, würde [Ar] seien alle inneren Schichten blau gefärbt; und 4s die hellblaue Schicht, die äußere.
Eigenschaften
Aus all dem oben Gesagten können einige Eigenschaften der Valenzschale für alle Atome zusammengefasst werden:
-Dein Energieniveau ist höher; was gleich ist, es ist weiter vom Kern entfernt und hat die niedrigste Elektronendichte (im Vergleich zu anderen Schichten).
-Es ist unvollständig. Daher füllt es sich weiterhin mit Elektronen, wenn eine Periode im Periodensystem von links nach rechts durchlaufen wird..
-Eingriffe in die Bildung kovalenter oder ionischer Bindungen.
Bei den Metallen Kalium und Calcium werden sie zu Kationen oxidiert. Das K+ Es hat eine elektronische [Ar] -Konfiguration, da es sein einziges externes Elektron 4s verliert1. Und auf der Seite von Ca.zwei+, seine Konfiguration ist auch [Ar]; denn anstatt ein Elektron zu verlieren, verlieren Sie zwei (4s)zwei).
Aber was ist der Unterschied zwischen dem K.+ und die Ca.zwei+, Wenn beide die Elektronen aus ihrer Valenzschale verlieren und eine [Ar] -Elektronenkonfiguration haben? Der Unterschied liegt in ihren Ionenradien. ACzwei+ ist kleiner als K.+, weil das Calciumatom ein zusätzliches Proton hat, das externe Elektronen mit größerer Kraft anzieht (geschlossene oder Valenzschalen).
Die Valenzschicht 4s ist nicht verschwunden: Sie ist nur für diese Ionen leer.
Beispiele
Das Konzept der Valenzschale findet sich direkt oder indirekt in vielen Aspekten der Chemie. Da seine Elektronen diejenigen sind, die an der Bildung von Bindungen beteiligt sind, sollte sich jedes Thema, das sie anspricht (TEV, RPECV, Reaktionsmechanismen usw.), auf diese Schicht beziehen.
Dies liegt daran, dass ihre Elektronen wichtiger sind als die Valenzschale; Valenzelektronen genannt. Wenn sie in der fortschreitenden Konstruktion elektronischer Konfigurationen dargestellt werden, definieren diese die elektronische Struktur des Atoms und damit seine chemischen Eigenschaften..
Aus diesen Informationen eines Atoms A und eines anderen B können die Strukturen ihrer Verbindungen durch die Lewis-Strukturen umrissen werden. Ebenso können die elektronischen und molekularen Strukturen einer Reihe von Verbindungen dank der Anzahl der Valenzelektronen bestimmt werden..
Die einfachsten und möglichen Beispiele für Valenzschichten finden sich im Periodensystem; speziell in Elektronenkonfigurationen.
Beispiel 1
Ein Element und seine Position im Periodensystem können nur mit der Elektronenkonfiguration identifiziert werden. Wenn also ein Element X die Konfiguration [Kr] 5s hatzwei5 p1, Was ist es und zu welcher Zeit und Gruppe gehört es??
Angenommen n= 5, X ist in der fünften Periode. Zusätzlich hat es drei Valenzelektronen: zwei im 5s-Orbitalzwei und einer in der 5p1. Die innere Schicht [Kr] liefert keine weiteren Informationen.
Da X drei Elektronen hat und seine 5p-Orbitale unvollständig sind, befindet es sich im p-Block; außerdem in Gruppe IIIA (romanisches System) oder 13 (aktuelles Nummerierungssystem und von der IUPAC genehmigt). X ist dann das Element Indianer.
Beispiel 2
Was ist das Element X mit Elektronenkonfiguration [Kr] 4d105s1? Beachten Sie, dass es wie In zur Periode 5 gehört, da das 5s-Orbital1 es ist derjenige mit der höchsten Energie. Die Valenzschale enthält jedoch auch die 4d-Orbitale, da dies der Fall ist unvollständig.
Die Valenzschichten können dann als nsnp für ein Element des p- oder s-Blocks bezeichnet werden; oder (n-1) dns für ein Element von Block d. Das mysteriöse Element X gehört also zu Block d, weil seine elektronische Konfiguration vom Typ (n-1) dns (4d) ist105s1).
Zu welcher Gruppe gehörst du? Addition der zehn Elektronen des 4d-Orbitals10, und einer von 5s1, X hat elf Valenzelektronen. Daher muss es in Gruppe IB oder 11 eingeordnet werden. Wenn man dann durch Periode 5 des Periodensystems zu Gruppe 11 geht, stößt man auf das Element Silber Ag.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Ausgabe, S. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 287.
- NDT Resource Center. (s.f.). Die Valenzschale. Entnommen aus: nde-ed.org
- Clackamas Community College. (2002). Valenzelektronen. Wiederhergestellt von: dl.clackamas.edu
- Chemie LibreTexts. (s.f.). Valenz- und Kernelektronen. Wiederhergestellt von: chem.libretexts.org


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.