
Butanonstruktur, Eigenschaften und Verwendungen
Das Butanon ist eine organische Verbindung, insbesondere ein Keton, dessen chemische Formel CH ist3CHzweiWagen3. Sein Aussehen ist das einer farblosen Flüssigkeit, die hauptsächlich als Lösungsmittel verwendet wird. Hat ähnliche Eigenschaften wie Aceton, siedet jedoch bei einer höheren Temperatur und verdampft langsamer.
Es entsteht durch katalytische Dehydrierung von 2-Butanol (chirale Verbindung). Es kommt jedoch in seinem natürlichen Zustand in der Zusammensetzung einiger Früchte vor. Es ist Teil der Dämpfe aus den Auspuffrohren von Fahrzeugen und Bestandteil des Tabakrauchs.
Es ist nach Aceton das einfachste dieser Familie organischer Verbindungen. Butanon reizt Augen und Nase. Bei ungewöhnlich hohen Dosen kann es zu einer Reizung der Lungenschleimhaut kommen. Andererseits wird diese Flüssigkeit als Vorläufer für Betäubungsmittel angesehen..
Butanon ist in Wasser sehr gut löslich; Es ist aber auch in organischen Lösungsmitteln wie Ethanol, Ether, Aceton, Benzol und Chloroform sehr gut löslich. Dies könnte erklärt werden, weil Ihr logarithmischer Wert von P (0,29) für den Oktan / Wasser-Verteilungskoeffizienten niedrig ist.
Artikelverzeichnis
- 1 Struktur von Butanon
- 2 Eigenschaften
- 2.1 Summenformel
- 2.2 Namen
- 2,3 Molmasse
- 2.4 Physikalische Beschreibung
- 2.5 Geruch
- 2.6 Siedepunkt
- 2.7 Schmelzpunkt
- 2.8 Flammpunkt
- 2.9 Löslichkeit in Wasser
- 2.10 Löslichkeit in organischen Lösungsmitteln
- 2.11 Dichte
- 2.12 Dampfdichte
- 2.13 Dampfdruck
- 2.14 Octanol / Wasser-Verteilungskoeffizient
- 2.15 Selbstentzündungstemperatur
- 2.16 Zersetzung
- 2.17 Viskosität
- 2.18 Verbrennungswärme
- 2.19 Verdampfungswärme
- 2.20 Oberflächenspannung
- 2.21 Ionisationspotential
- 2.22 Geruchsschwelle
- 2.23 Brechungsindex
- 2.24 Dissoziationskonstante
- 2.25 Stabilität
- 3 Verwendungen
- 3.1 Lösungsmittel
- 3.2 Reagenz
- 3.3 Kunststoffzement
- 3.4 Andere Verwendungen
- 4 Referenzen
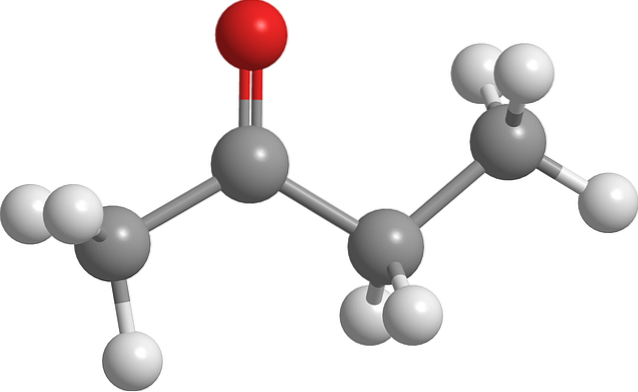
Struktur von Butanon
Das Bild oben zeigt das Butanonmolekül mit einem Ball-and-Stick-Modell. Das Sauerstoffatom der Carbonylgruppe (rote Kugel) ist am zweiten Kohlenstoff zu sehen. Diese Gruppe, C = O, ist dafür verantwortlich, dem Molekül ein permanentes Dipolmoment zu verleihen.
Strukturell gesehen ist Butanon nichts anderes als ein Aceton, dem eine Methylengruppe, CH, zugesetzt wurdezwei. Da mehr Kohlenstoffe vorhanden sind, ist das Dipolmoment im Vergleich zu Aceton kleiner. aber seine höhere Molekülmasse lässt es bei einer höheren Temperatur kochen.
Diesem Molekül fehlt wie anderen Ketonen die Fähigkeit, Wasserstoffbrückenbindungen zu bilden. und deshalb sind ihre Dipol-Dipol-Wechselwirkungen nicht so stark.
Deshalb ist es eine flüchtige Flüssigkeit. Wenn die Temperatur sinkt (-86,6 ° C), orientieren die schwachen Dipole die Moleküle in geordneter Weise, um einen Kristall zu bilden. Darüber hinaus kann auch angemerkt werden, dass Butanon strukturell asymmetrisch ist.
Eigenschaften
Molekularformel
C.4H.8O oder CH3WagenzweiCH3
Namen
- Butanon.
- 2-Butanon.
- Butan-2-eins.
- Methyl-Ethyl Ketone.
Molmasse
72,107 g / mol.
Physische Beschreibung
Farblose Flüssigkeit.
Geruch
Minze duftend, mäßig stark.
Siedepunkt
79,59 ° C bei 760 mmHg.
Schmelzpunkt
-86,6 ºC.
Zündpunkt
-9 ºC (geschlossene Tasse).
Wasserlöslichkeit
29 g / 100 ml bei 20 ° C. Obwohl sein Dipolmoment geringer ist als das von Aceton, kann es dennoch in ausgezeichnetem Maße mit Wassermolekülen interagieren. Von ihnen erhält es Wasserstoffbrücken: (CH3) (CHzweiCH3) C = O-HOH. Aufgrund dessen ist es in Wasser sehr gut löslich.
Löslichkeit in organischen Lösungsmitteln
Löslich in Benzol, Alkohol und Ether; Mit Öl, Ethanol, Ether, Aceton, Benzol und Chloroform mischbar. Es ist zu beachten, dass Butanon in einer Vielzahl von Lösungsmitteln löslich ist.
Dichte
0,7997 g / cm3 bei 25 ºC.
Wasserdampfdichte
2,41 (relativ zu Wasser = 1).
Dampfdruck
90,6 mmHg bei 25 ºC.
Octanol / Wasser-Verteilungskoeffizient
Log P = 0,29
Selbstentzündungstemperatur
505 ºC.
Zersetzung
Es wird durch photochemische Prozesse durch Oxidation durch freie Hydroxylradikale sowie durch direkte Photolysezersetzung zersetzt. Wenn es zur Zersetzung erhitzt wird, gibt es scharfen Rauch ab.
Viskosität
0,40 cPoise bei 25 ° C..
Verbrennungswärme
2.444,1 kJ / mol bei 25 ºC.
Verdampfungswärme
31,30 kJ / mol am Siedepunkt; und 34,79 kJ / mol bei 25ºC.
Oberflächenspannung
23,97 mN / m bei 25 ºC.
Ionisationspotential
0,54 eV.
Geruchsschwelle
Geruchsarm: 0,735 mg / m3.
Hoher Geruch: 147,5 mg / m3.
Brechungsindex
1.788 bei 20 ºC.
Dissoziationskonstante
pKa = 14,70.
Stabilität
Stabil, aber leicht entflammbar. Unverträglich mit starken Oxidationsmitteln, Basen und Reduktionsmitteln. Feuchtigkeit sollte vermieden werden.
Anwendungen
Lösungsmittel
Butanon wird als Lösungsmittel bei der Herstellung von Oberflächenbeschichtungen, der Herstellung von rauchfreien Pulvern, der Herstellung von farbigen Harzen und bei der Entfernung von Fettansammlungen verwendet, die durch Schmiermittel erzeugt werden.
Darüber hinaus wird es bei der Ausarbeitung von:
- Kunstleder.
- Gummi.
- Lacke.
- Lacke.
- Kleber.
- Lösungsmittel.
- Farbentferner.
- Klebstoffe.
- Kunststoffzemente.
- Dichtungsmittel.
- Magnetbänder.
- Transparentes Papier.
- Druckfarben.
- Kosmetik und Pharmazeutika.
Es wird auch als Lösungsmittel zum Entfetten von Metalloberflächen, zur Reinigung elektronischer Geräte und zur Fettabsaugung verwendet. Es wird zur Gewinnung von Hartholz und Pflanzenöl verwendet.
Es ist ein inerter Bestandteil bei der Herstellung von Pestiziden und bei der Herstellung von Celluloseacetat und Cellulosenitrat.
Es wird als Extraktionslösungsmittel bei der Verarbeitung von Lebensmitteln und Lebensmittelzutaten verwendet. zum Beispiel bei der Fraktionierung von Fetten und Ölen sowie beim Entkoffeinierungsprozess von Kaffee. Wird auch als Lösungsmittel in Markern verwendet, die auf Whiteboards verwendet werden.
Reagens
- Butanon wird als wasserlöslicher Photoinitiator für die Photopolymerisation von Methacrylsäure verwendet..
- Es kondensiert mit Formaldehyd unter Bildung von Isopropenylketon.
- Erlebt Selbstkondensation zur Herstellung von Ethylamylketon.
- Reagiert mit Citral, um Parfümkomponenten wie Methylpseudoionon zu erhalten.
- Interveniert als Katalysator bei der Herstellung von Hydrazin.
- Zusätzlich ist es ein Vorläufer von Methylethylketonperoxid, das ein Katalysator für einige Polymerisationsreaktionen ist..
Kunststoffzement
Butanon findet Anwendung als Kunststoffschweißmittel bei der Montage von Modellen im Polystyrolmaßstab. Das Butanon löst das Polystyrol auf, so dass die Kanten zusammenkommen, wenn eine neue Polymerisation auftritt. Dieses Verhalten besteht aus einem Zement und nicht aus einem Klebstoff.
Andere Verwendungen
Butanon wird als bakterieller Sporensterilisator in chirurgischen Instrumenten, Nadeln, Injektionsinjektoren und zahnärztlichen Instrumenten verwendet..
Es wird als Lebensmittelaromastoff in sehr geringen Konzentrationen verwendet; Beispielsweise beträgt in alkoholischen Getränken die Konzentration 20 ppm; in Backwaren 12,7 ppm; Fleisch hat ungefähr 26,5 ppm; Kaugummi, 0,63 ppm; und in Fetten und Ölen 1,0 ppm.
Und schließlich wird Butanon bei der Trennung des Apoproteins von der Hämgruppe in den Hemeproteinen verwendet..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5ta Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10thAuflage.). Wiley plus.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Methylethylketon PubChem-Datenbank. CID = 6569. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanon. Wiederhergestellt von: en.wikipedia.org
- Royal Society of Chemistry. (2015). Butanon. Chemspider. Wiederhergestellt von: chemspider.com
- Arlem Cheprasov. (2019). Was ist Butanon? Formel & Verwendungen. Studie. Wiederhergestellt von: study.com
- Vasler Ben. (17. Mai 2017). Butanon. Welt der Chemie. Wiederhergestellt von: chemistryworld.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.