
Eigenschaften, Synthese und Verwendung von Bromwasserstoff (HBr)

Das Bromwasserstoff, Als chemische Verbindung der Formel HBr handelt es sich um ein zweiatomiges Molekül mit einer kovalenten Bindung. Die Verbindung wird als Halogenwasserstoff klassifiziert, wobei es sich um ein farbloses Gas handelt, das, wenn es in Wasser gelöst wird, Bromwasserstoffsäure bildet, die sich bei Raumtemperatur mit 68,85 Gew .-% sättigt..
Wässrige Lösungen mit 47,6 Gew .-% bilden eine konstant siedende azeotrope Mischung, die bei 124,3 Grad Celsius siedet. Weniger konzentrierte, siedende Lösungen setzen H 2 O frei, bis die Zusammensetzung des konstant siedenden azeotropen Gemisches erreicht ist..
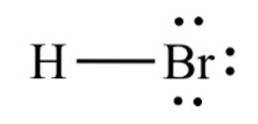
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Handhabung und Lagerung
- 4 Synthese
- 5 Verwendungen
- 6 Referenzen
Physikalische und chemische Eigenschaften
Bromwasserstoff ist bei Raumtemperatur ein farbloses Gas mit einem sauren, reizenden Geruch. Die Verbindung ist stabil, verdunkelt sich jedoch allmählich, wenn sie Luft oder Licht ausgesetzt wird, wie in 2 dargestellt (Nationales Zentrum für Biotechnologie-Informationen, S.F.)..

Es hat ein Molekulargewicht von 80,91 g / mol und eine Dichte von 3,307 g / l, was es schwerer als Luft macht. Das Gas kondensiert unter Bildung einer farblosen Flüssigkeit mit einem Siedepunkt von -66,73 Grad Celsius.
Beim weiteren Abkühlen verfestigt sich die Flüssigkeit unter Erhalt weißer Kristalle, deren Schmelzpunkt -86,82 Grad Celsius bei einer Dichte von 2,603 g / ml beträgt (Egon Wiberg, 2001). Das Aussehen dieser Kristalle ist in Abbildung 3 dargestellt.

Der Bindungsabstand zwischen Brom und Wasserstoff beträgt 1,414 Angström und ihre Dissoziationsenergie beträgt 362,5 kJ / mol..
Bromwasserstoff ist wasserlöslicher als Chlorwasserstoff. 221 g können in 100 ml Wasser bei 0 Grad Celsius gelöst werden, was einem Volumen von 612 Litern dieses Gases pro Liter Wasser entspricht. Es ist auch in Alkohol und anderen organischen Lösungsmitteln löslich.
In wässriger Lösung (Bromwasserstoffsäure) dominieren die sauren Eigenschaften von HBr (wie im Fall von HF und HCl) und in der Bindung zwischen Wasserstoff und Halogen ist sie im Fall von Bromwasserstoff schwächer als in Chlorwasserstoff.
Wenn Chlor durch den Bromwasserstoff geleitet wird, wird daher die Bildung von braunen Dämpfen beobachtet, die für molekulares Brom charakteristisch sind. Die Reaktion, die es erklärt, ist die folgende:
2HBr + Cl2 → 2HCl + Br2
Dies weist darauf hin, dass Bromwasserstoff ein stärkeres Reduktionsmittel als Chlorwasserstoff ist und dass Chlorwasserstoff ein besseres Oxidationsmittel ist..
Bromwasserstoff ist eine wasserfreie starke Säure (ohne Wasser). Reagiert schnell und exotherm mit Basen aller Art (einschließlich Aminen und Amiden).
Reagiert exotherm mit Carbonaten (einschließlich Kalkstein und kalksteinhaltigen Baumaterialien) und Hydrogencarbonaten unter Bildung von Kohlendioxid.
Reagiert mit Sulfiden, Carbiden, Boriden und Phosphiden unter Bildung giftiger oder brennbarer Gase.
Reagiert mit vielen Metallen (einschließlich Aluminium, Zink, Calcium, Magnesium, Eisen, Zinn und allen Alkalimetallen) unter Bildung von brennbarem Wasserstoffgas.
Antworten Sie heftig mit:
- Essigsäureanhydrid
- 2-Aminoethanol
- Ammoniumhydroxid
- Calciumphosphid
- Chlorsulfonsäure
- 1,1-Difluorethylen
- Ethylendiamin
- Ethylenimin
- rauchende Schwefelsäure
- Perchlorsäure
- b-Propriolacton
- Propylen-OXID
- Silberperchlorat
- Uran (IV) phosphid
- Vinylacetat
- Calciumcarbid
- Rubidiumcarbid
- Cäsiumacetylid
- Rubidiumacetylid
- Magnesiumborid
- Quecksilber (II) sulfat
- Calciumphosphid
- Calciumcarbid (Chemisches Datenblatt, 2016).
Reaktivität und Gefahren
Bromwasserstoff wird als ätzende und reizende Verbindung eingestuft. Es ist äußerst gefährlich bei Kontakt mit der Haut (reizend und ätzend) und den Augen (reizend) sowie bei Verschlucken und Einatmen (lungenreizend)..
Die Verbindung wird in unter Druck stehenden Flüssiggasbehältern gelagert. Längerer Kontakt mit Feuer oder starker Hitze kann zu einem heftigen Bruch des Druckbehälters führen, der freigesetzt werden kann und reizende giftige Dämpfe freisetzt..
Eine langfristige Exposition gegenüber niedrigen Konzentrationen oder eine kurzfristige Exposition gegenüber hohen Konzentrationen kann durch Einatmen zu gesundheitsschädlichen Auswirkungen führen..
Bei der thermischen Zersetzung von wasserfreiem Bromwasserstoff entstehen giftige Bromgase. Es kann brennbar werden, wenn es unter Freisetzung von Wasserstoff reagiert. Kontakt mit Cyanid erzeugt giftige Cyanwasserstoffgase.
Das Einatmen führt zu einer starken Reizung der Nase und der oberen Atemwege, die zu Lungenverletzungen führen kann..
Verschlucken verursacht Verbrennungen an Mund und Magen. Augenkontakt verursacht starke Reizungen und Verbrennungen. Hautkontakt verursacht Reizungen und Verbrennungen.
Wenn diese in Lösung befindliche Chemikalie mit den Augen in Kontakt kommt, sollten sie sofort mit großen Mengen Wasser gespült werden, wobei gelegentlich die unteren und oberen Augenlider angehoben werden..
Kontaktlinsen sollten bei der Arbeit mit dieser Chemikalie nicht getragen werden. Wenn das Augengewebe gefroren ist, suchen Sie sofort einen Arzt auf..
Wenn das Gewebe nicht gefroren ist, spülen Sie die Augen sofort und gründlich mindestens 15 Minuten lang mit großen Mengen Wasser aus und heben Sie gelegentlich die unteren und oberen Augenlider an..
Wenn Reizungen, Schmerzen, Schwellungen oder Risse bestehen bleiben, suchen Sie so bald wie möglich einen Arzt auf..
Wenn diese in Lösung befindliche Chemikalie mit der Haut in Kontakt kommt und keine Erfrierungen verursacht, spülen Sie kontaminierte Haut sofort mit Wasser ab.
Wenn diese Chemikalie auf die Kleidung gelangt, entfernen Sie sofort die Kleidung und waschen Sie die Haut mit Wasser.
Bei Erfrierungen sofort einen Arzt aufsuchen. Sie sollten die betroffenen Stellen nicht reiben oder mit Wasser abspülen. Um weitere Schäden an Stoffen zu vermeiden, sollte nicht versucht werden, gefrorene Kleidung aus frostigen Bereichen zu entfernen..
Wenn große Mengen dieser Chemikalie eingeatmet werden, sollte die exponierte Person sofort an die frische Luft gebracht werden. Wenn die Atmung gestoppt ist, führen Sie eine Mund-zu-Mund-Beatmung durch. Das Opfer sollte warm und in Ruhe gehalten werden, und es sollte so bald wie möglich ein Arzt aufgesucht werden..
Wenn diese Chemikalie in Lösung verschluckt wurde, suchen Sie sofort einen Arzt auf.
Handhabung und Lagerung
Bromwasserstoffflaschen sollten an einem kühlen, gut belüfteten Ort gelagert werden. Die Handhabung muss ausreichend belüftet sein. Es sollte nur gelagert werden, wenn die Temperatur 52 Grad Celsius nicht überschreitet.
Die Behälter sollten in aufrechter Position fest gesichert sein, damit sie nicht herunterfallen oder getroffen werden können. Installieren Sie auch die Ventilschutzkappe, falls vorhanden, fest von Hand und lagern Sie volle und leere Behälter getrennt (praxair inc., 2016)..
Beim Umgang mit unter Druck stehenden Produkten sollten ordnungsgemäß ausgelegte Rohrleitungen und Geräte verwendet werden, um den auftretenden Drücken standzuhalten. Arbeiten Sie niemals an einem unter Druck stehenden System und verwenden Sie ein Rückflussverhinderungsgerät in der Rohrleitung. Gase können aufgrund von Sauerstoffmangel schnell ersticken.
Lagerung und Verwendung bei ausreichender Belüftung ist wichtig. Wenn ein Leck auftritt, schließen Sie das Behälterventil und schalten Sie das System auf sichere und umweltfreundliche Weise aus. Dann reparieren Sie das Leck. Stellen Sie einen Behälter niemals so auf, dass er Teil eines Stromkreises sein kann.
Beim Umgang mit Zylindern sollten Lederhandschuhe und geeignete Schuhe getragen werden. Diese müssen geschützt und zu diesem Zweck vermieden, gezogen, gerollt oder verschoben werden..
Beim Bewegen des Zylinders sollte der abnehmbare Ventildeckel immer an Ort und Stelle bleiben. Versuchen Sie niemals, einen Zylinder an seinem Deckel anzuheben, der ausschließlich zum Schutz des Ventils bestimmt ist..
Verwenden Sie zum Bewegen von Zylindern auch auf kurzen Strecken einen Wagen (Wagen, Handwagen usw.), der zum Transport von Zylindern ausgelegt ist.
Ein Gegenstand (z. B. Schraubenschlüssel, Schraubendreher, Hebelstange) sollte niemals in die Öffnungen in der Abdeckung eingeführt werden, da dies das Ventil beschädigen und ein Leck verursachen kann..
Mit einem verstellbaren Gurtschlüssel werden zu dichte oder verrostete Kappen entfernt. Das Ventil sollte sich langsam öffnen. Wenn dies nicht möglich ist, verwenden Sie es nicht mehr und wenden Sie sich an Ihren Lieferanten. Natürlich muss das Ventil am Behälter nach jedem Gebrauch geschlossen werden..
Der Behälter muss auch im leeren Zustand geschlossen bleiben. Flammen oder örtlich begrenzte Wärme dürfen niemals direkt auf einen Teil des Behälters angewendet werden. Hohe Temperaturen können den Behälter beschädigen und dazu führen, dass die Druckentlastungsvorrichtung vorzeitig ausfällt und der Inhalt des Behälters entlüftet wird (praxair inc., 2016)..
Synthese
Bromwasserstoffgas kann im Labor durch Bromierung von Tetralin (1,2,3,4-Tetrahydronaphthalin) hergestellt werden. Der Nachteil ist, dass die Hälfte des Broms verloren geht. Die Ausbeute beträgt ungefähr 94%, oder was gleich ist, 47% des Broms enden als HBr.
C.10H.12 + 4 Brzwei → C.10H.8Br4 + 4 HBr
Bromwasserstoffgas kann auch im Labor durch Umsetzung von konzentrierter Schwefelsäure mit Natriumbromid synthetisiert werden..
NaBr (s) + H.zweiSW4 → HBr (g) + NaHSO4
Der Nachteil dieses Verfahrens besteht darin, dass ein Großteil des Produkts durch Oxidation mit überschüssiger Schwefelsäure unter Bildung von Brom und Schwefeldioxid verloren geht..
2 HBr + H.zweiSW4 → Brzwei + SWzwei + 2 hzweiODER
Bromwasserstoff kann im Labor durch die Reaktion zwischen gereinigtem Wasserstoffgas und Brom hergestellt werden. Dies wird durch Platinasbest katalysiert und in einem Quarzrohr bei 250 ° C durchgeführt.
Brzwei + H.zwei[Pt] → 2 HBr
Wasserfreier Bromwasserstoff kann auch in kleinem Maßstab durch Thermolyse von Triphenylphosphoniumbromid in Xylol unter Rückfluss hergestellt werden..
HBr kann durch das Rotphosphorverfahren erhalten werden. Zuerst wird der rote Phosphor in den Wasserreaktor gegeben und später wird langsam das Brom unter Rühren und die Reaktion von Bromwasserstoffsäure und Phosphorsäure durch Sedimentation, Filtration und die erhaltene Destillation Bromwasserstoffsäure sein..
P.4+6 Brzwei+12 hzweiO → 12 HBr + 4 H.3PO3
Bromwasserstoff, der durch die obigen Verfahren hergestellt wurde, kann mit Br kontaminiert werdenzwei, das entfernt werden kann, indem das Gas durch eine Lösung von Phenol in Tetrachlormethan oder einem anderen geeigneten Lösungsmittel bei Raumtemperatur geleitet wird, wodurch 2, 4, 6-Tribromphenol erzeugt wird und dadurch mehr HBr erzeugt wird.
Dieser Prozess kann auch durch Hochtemperatur-Kupferchips oder Kupfergaze durchgeführt werden (Wasserstoff: Bromwasserstoff, 1993-2016)..
Anwendungen
HBr wird zur Herstellung von organischen Bromiden wie Methylbromid, Bromethan usw. und anorganischen wie Natriumbromid, Kaliumbromid, Lithiumbromid und Calciumbromid usw. verwendet..
Es wird auch in fotografischen und pharmazeutischen Anwendungen oder zur Synthese von Beruhigungsmitteln und Anästhetika verwendet. Darüber hinaus wird es in der industriellen Trocknung, Textilveredelung, Beschichtungsmitteln, Oberflächenbehandlung und Brandschutzmitteln eingesetzt..
Die Verbindung wird auch zum Ätzen von Polysiliciumfolien zur Herstellung von Computerchips verwendet (Interscan Corporation, 2017)..
Bromwasserstoff ist ein gutes Lösungsmittel für einige Metallerze, das zur Veredelung hochreiner Metalle verwendet wird.
In der Erdölindustrie wird es als Trennung von Alkoxy- und Phenoxyverbindungen und als Katalysator für die Oxidation von cyclischen Kohlenwasserstoffen und Kettenkohlenwasserstoffen zu Ketonen, Säure oder Peroxid verwendet. Es wird auch in synthetischen Farbstoffen und Gewürzen verwendet..
Ein hochwertiges HBr-Gas wird zum Ätzen und Reinigen von Halbleiterrohstoffen verwendet (SHOWA DENKO K.K., n. D.)..
Die Verbindung wird als analytisches Reagenz bei der Bestimmung von Schwefel, Selen, Wismut, Zink und Eisen zur Trennung von Zinn von Arsen und Antimon verwendet. Es ist ein Alkylierungskatalysator und Reduktionsmittel, die bei der organischen Synthese verwendet werden.
Bromwasserstoff kann zur Herstellung von Bromwasserstoffsäure verwendet werden. Bromwasserstoffsäure ist eine sehr starke Mineralsäure, die stärker als Salzsäure ist.
HBr ist für die meisten Metalle hochreaktiv und ätzend. Säure ist ein in der organischen Chemie übliches Reagenz, das zur Oxidation und Katalyse verwendet wird. Es ist auch wirksam bei der Extraktion bestimmter metallischer Mineralien (Bromwasserstoff, 2016).
Verweise
- Interscan Corporation. (2017). Instrumentierung zur Überwachung von Bromwasserstoff und Bromwasserstoff. Von gasdetection.com abgerufen.
- Chemisches Datenblatt. (2016). Abgerufen von WASSERSTOFFBROMID, ANHYDROUS: comeochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Anorganische Chemie. Akademische Presse.
- Bromwasserstoff. (2016). Aus ChemicalBook abgerufen.
- Wasserstoff: Bromwasserstoff. (1993-2016). Von WebElements abgerufen.
- Sicherheitsdatenblatt Bromwasserstoff. (2005, 9. Oktober). Von sciencelab.com abgerufen.
- Nationales Zentrum für Informationen zur Biotechnologie. (S.F.). PubChem Compound Database; CID = 260. Abgerufen von pubchem.ncbi.nlm.nih.gov.
- praxair inc. (2016, 17. Oktober). Bromwasserstoff, wasserfreies Sicherheitsdatenblatt P-4605. Von praxair.com abgerufen.
- SHOWA DENKO K.K. (s.f.). Bromwasserstoff. Abgerufen von www.sdk.co.jp..

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.