
Bromgeschichte, Struktur, Elektronenkonfiguration, Eigenschaften, Verwendungen
Das Brom Es ist ein nichtmetallisches Element, das zur Gruppe der Halogene, Gruppe 17 (VIIA) des Periodensystems, gehört. Sein chemisches Symbol ist Br. Es erscheint als zweiatomiges Molekül, dessen Atome durch eine kovalente Bindung verbunden sind, für die ihm die Summenformel Br zugeordnet istzwei.
Im Gegensatz zu Fluor und Chlor ist Brom unter terrestrischen Bedingungen kein Gas, sondern eine rotbraune Flüssigkeit (Bild unten). Es raucht und ist zusammen mit Quecksilber die einzigen flüssigen Elemente. Darunter kann Jod, obwohl es seine Farbe intensiviert und lila wird, zu einem flüchtigen Feststoff kristallisieren.

Brom wurde 1825 von Carl Löwig entdeckt, der unter der Leitung des deutschen Chemikers Leopold Gmelin studierte. und 1826 vom französischen Chemiker Antoine-Jérome Balard. Die Veröffentlichung von Balards experimentellen Ergebnissen ging jedoch Löwigs voraus..
Brom ist das 62. am häufigsten vorkommende Element auf der Erde und in geringen Konzentrationen in der Erdkruste verteilt. Im Meer beträgt die durchschnittliche Konzentration 65 ppm. Der menschliche Körper enthält 0,0004% Brom und seine Funktion ist nicht definitiv bekannt..
Dieses Element wird kommerziell in Salzlaken oder an Orten genutzt, an denen aufgrund besonderer Bedingungen Orte mit hoher Salzkonzentration vorhanden sind. Zum Beispiel das Tote Meer, zu dem die Gewässer der Nachbargebiete zusammenlaufen, gesättigt mit Salzen.
Es ist ein ätzendes Element, das Metalle wie Platin und Palladium angreifen kann. In Wasser gelöst kann Brom auch seine ätzende Wirkung auf menschliches Gewebe ausüben, was die Situation verschlimmert, da Bromwasserstoffsäure erzeugt werden kann. In Bezug auf seine Toxizität kann es erhebliche Schäden an Organen wie Leber, Nieren, Lunge und Magen verursachen.
Brom ist in der Atmosphäre sehr schädlich und für die Ozonschicht 40-100-mal zerstörerischer als Chlor. Die Hälfte des Verlusts der Ozonschicht in der Antarktis wird durch Reaktionen im Zusammenhang mit Brommethyl, einer als Begasungsmittel verwendeten Verbindung, verursacht.
Es hat zahlreiche Verwendungszwecke, wie zum Beispiel: Feuerhemmer, Bleichmittel, Oberflächendesinfektionsmittel, Kraftstoffadditiv, Zwischenprodukte bei der Herstellung von Beruhigungsmitteln, bei der Herstellung von organischen Chemikalien usw..
Artikelverzeichnis
- 1 Geschichte
- 1.1 Carl Löwigs Arbeit
- 1.2 Antoine Balards Arbeit
- 2 Struktur und Elektronenkonfiguration von Brom
- 2.1 Molekül
- 2.2 Kristalle
- 2.3 Valenzschicht und Oxidationsstufen
- 3 Eigenschaften
- 3.1 Aussehen
- 3.2 Atomgewicht
- 3.3 Ordnungszahl
- 3.4 Geruch
- 3.5 Schmelzpunkt
- 3.6 Siedepunkt
- 3.7 Dichte (Br2) Flüssigkeit
- 3.8 Löslichkeit in Wasser
- 3.9 Löslichkeiten
- 3.10 Dreifachpunkt
- 3.11 Kritischer Punkt
- 3.12 Schmelzwärme (Br2)
- 3.13 Verdampfungswärme (Br2)
- 3.14 Molare Wärmekapazität (Br2)
- 3.15 Dampfdruck
- 3.16 Selbstentzündungstemperatur
- 3.17 Flammpunkt
- 3.18 Lagertemperatur
- 3.19 Oberflächenspannung
- 3.20 Geruchsschwelle
- 3.21 Brechungsindex (ηD)
- 3.22 Elektronegativität
- 3.23 Ionisierungsenergie
- 3.24 Atomradius
- 3.25 Kovalenter Radius
- 3.26 Van-der-Waals-Radius
- 3.27 Reaktivität
- 4 Verwendungen
- 4.1 Benzinzusatz
- 4.2 Pestizide
- 4.3 Kontrolle der Quecksilberemission
- 4.4 Fotografie
- 4.5 Therapeutische Wirkungen
- 4.6 Feuerhemmend
- 4.7 Lebensmittelzusatzstoff
- 4.8 Reagenzien und chemische Zwischenprodukte
- 4.9 Biologische Wirkung
- 5 Wo zu finden
- 6 Risiken
- 7 Referenzen
Geschichte
Carl Löwigs Arbeit
Brom wurde 1825 von Carl Jacob Löwig, einem deutschen Chemiker, und 1826 von Antoine Balard, einem französischen Chemiker, unabhängig und fast gleichzeitig entdeckt..
Carl Löwig, ein Schüler des deutschen Chemikers Leopold Gmelin, sammelte Wasser aus einer Quelle in Bad Kreuznach und fügte Chlor hinzu; Nach Zugabe des Ethers wurde das flüssige Gemisch gerührt.
Dann wurde der Ether abdestilliert und durch Eindampfen eingeengt. Als Ergebnis erhielt er eine rotbraune Substanz, die Brom war.
Antoine Balards Arbeit
Balard seinerseits verwendete Asche aus einer Braunalge, die als Fucus bekannt ist, und mischte sie mit Salzlake, die aus den Salzwiesen von Montpellier gewonnen wurde. So setzte er das Brom frei und ließ Chlor durch das zu extrahierende wässrige Material laufen, in dem das Magnesiumbromid MgBr vorhanden war.zwei.
Anschließend wurde das Material in Gegenwart von Mangandioxid und Schwefelsäure destilliert, wobei rote Dämpfe erzeugt wurden, die zu einer dunklen Flüssigkeit kondensierten. Balard hielt es für ein neues Element und nannte es muride, abgeleitet vom lateinischen Wort muria, mit dem Sole bezeichnet wurde.
Es wurde festgestellt, dass Balard auf Vorschlag von Anglada oder Gay-Lussac den Namen von muride in brôme änderte, basierend auf der Tatsache, dass brôme Foul bedeutet, was den Geruch des entdeckten Elements definiert..
Die Ergebnisse wurden von Belard in Annales of Chemie and Physique veröffentlicht, bevor Löwig seine veröffentlichte.
Erst ab 1858 konnte Brom in erheblichen Mengen hergestellt werden; Jahr wurden die Stassfurter Salzvorkommen entdeckt und ausgebeutet, wobei Brom als Nebenprodukt von Kali entstand.
Struktur und Elektronenkonfiguration von Brom
Molekül

Das obere Bild zeigt das Brommolekül Brzwei, mit einem kompakten Füllmodell. Tatsächlich besteht eine einfache kovalente Bindung zwischen den beiden Bromatomen Br-Br.
Da es sich um ein homogenes und zweiatomiges Molekül handelt, fehlt ihm ein permanentes Dipolmoment und es kann nur mit Hilfe von Londoner Dispersionskräften mit anderen des gleichen Typs interagieren..
Dies ist der Grund, warum seine rötliche Flüssigkeit raucht; in Br-Molekülenzwei, Obwohl sie relativ schwer sind, halten sie ihre intermolekularen Kräfte lose zusammen.
Brom ist weniger elektronegativ als Chlor und wirkt sich daher weniger attraktiv auf die Elektronen in den Valenzschalen aus. Infolgedessen benötigt es weniger Energie, um höhere Energieniveaus zu erreichen, grüne Photonen zu absorbieren und eine rötliche Farbe zu reflektieren..
Kristalle
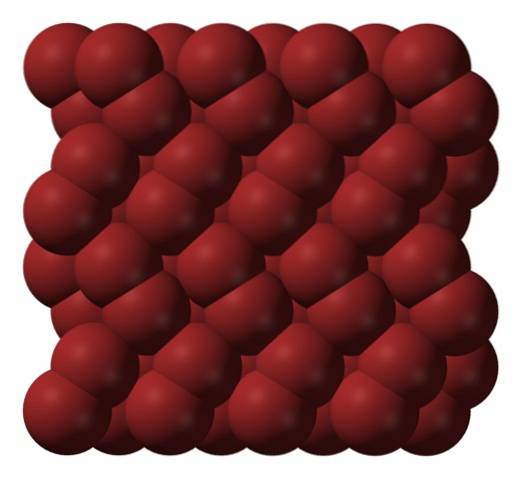
In der Gasphase sind die Br-Molekülezwei Sie trennen sich erheblich, bis keine effizienten Wechselwirkungen mehr zwischen ihnen bestehen. Unterhalb seines Schmelzpunktes kann Brom jedoch zu rötlichen orthorhombischen Kristallen gefrieren (oberes Bild).
Beachten Sie, wie die Br-Molekülezwei Sie sind ordentlich so angeordnet, dass sie wie "Bromwürmer" aussehen. Hier und bei diesen Temperaturen (T. < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valenzschicht und Oxidationsstufen
Die Elektronenkonfiguration von Brom ist:
[Ar] 3d104szwei 4p5
3d sein104szwei 4p5 seine Valenzschale (obwohl das 3D-Orbital10 spielen keine führende Rolle bei ihren chemischen Reaktionen). Die Elektronen in den 4s- und 4p-Orbitalen sind die äußersten und addieren sich zu insgesamt 7, nur ein Elektron nach Abschluss des Valenzoktetts.
Aus dieser Konfiguration können die möglichen Oxidationsstufen für Brom abgeleitet werden: -1, wenn es ein Elektron gewinnt, das für Krypton isoelektronisch ist; +1, bleibt als 3d104szwei 4p4;; +3, +4 und +5, wobei alle Elektronen aus dem 4p-Orbital verloren gehen ([Ar] 3d104szwei4p0); und +7, wobei keine Elektronen im 4s-Orbital verbleiben ([Ar] 3d104s04p0).
Eigenschaften
Aussehen
Dunkelrotbraune rauchende Flüssigkeit. Es kommt in der Natur als zweiatomiges Molekül vor, dessen Atome durch eine kovalente Bindung verbunden sind. Brom ist eine Flüssigkeit, die dichter als Wasser ist und darin versinkt.
Atomares Gewicht
79,904 g / mol.
Ordnungszahl
35.
Geruch
Ein stechender, erstickender und irritierender Rauch.
Schmelzpunkt
-7,2 ºC.
Siedepunkt
58,8 ºC.
Dichte (Brzwei) Flüssigkeit
3,1028 g / cm3
Wasserlöslichkeit
33,6 g / l bei 25 ° C. Die Löslichkeit von Brom in Wasser ist gering und nimmt mit abnehmender Temperatur tendenziell zu; Verhalten ähnlich wie bei anderen Gasen.
Löslichkeiten
Frei löslich in Alkohol, Ether, Chloroform, Tetrachlorkohlenstoff, Schwefelkohlenstoff und konzentrierter Salzsäure. Löslich in unpolaren und einigen polaren Lösungsmitteln wie Alkohol, Schwefelsäure und vielen halogenierten Lösungsmitteln.
Dreifacher Punkt
265,9 K bis 5,8 kPa.
Kritischer Punkt
588 K bei 10,34 MPa.
Schmelzwärme (Brzwei)
10.571 kJ / mol.
Verdampfungswärme (Brzwei)
29,96 kJ / mol.
Molare Wärmekapazität (Brzwei)
75,69 kJ / mol.
Dampfdruck
Bei einer Temperatur von 270 K 10 kPa.
Selbstentzündungstemperatur
Nicht brennbar.
Zündpunkt
113 ºC.
Lagertemperatur
2 bis 8 ºC.
Oberflächenspannung
40,9 mN / m bei 25 ºC.
Geruchsschwelle
0,05-3,5 ppm. 0,39 mg / m3
Brechungsindex (ηD)
1,6083 bei 20 ºC und 1,6478 bei 25 ºC.
Elektronegativität
2,96 auf der Pauling-Skala.
Ionisationsenergie
- Erste Stufe: 1.139,9 kJ / mol.
- Zweite Stufe: 2.103 kJ / mol.
- Dritte Stufe: 3.470 kJ / mol.
Atomradio
120 Uhr.
Kovalenter Radius
120,3 Uhr.
Van der Waals Radio
185 Uhr.
Reaktivität
Es ist weniger reaktiv als Chlor, aber reaktiver als Jod. Es ist ein Oxidationsmittel, das weniger stark als Chlor und stärker als Jod ist. Es ist auch ein schwächeres Reduktionsmittel als Jod, aber stärker als Chlor..
Chlordampf ist für viele Materialien und menschliches Gewebe stark ätzend. Greift viele metallische Elemente an, einschließlich Platin und Palladium; Es greift jedoch weder Blei, Nickel, Magnesium, Eisen, Zink und unter 300 ºC noch Natrium an.
Brom in Wasser verändert sich und wird zu Bromid. Es kann auch als Bromat (BrO) vorliegen3-), abhängig vom pH-Wert der Flüssigkeit.
Brom kann aufgrund seiner oxidierenden Wirkung die Freisetzung von freien Sauerstoffradikalen induzieren. Dies sind starke Oxidationsmittel und können Gewebeschäden verursachen. Außerdem kann sich Brom in Kombination mit Kalium, Phosphor oder Zinn spontan entzünden..
Anwendungen
Benzinzusatz
Ethylendibromid wurde verwendet, um mögliche Bleiablagerungen von Kraftfahrzeugmotoren zu entfernen. Nach der Verbrennung von Benzin, das Blei als Additiv verwendete, bildete Brom in Kombination mit Blei Bleibromid, ein flüchtiges Gas, das durch das Auspuffrohr ausgestoßen wurde..
Obwohl Brom Blei aus Benzin entfernte, war seine zerstörerische Wirkung auf die Ozonschicht sehr stark, weshalb es für diese Anwendung verworfen wurde.
Pestizide
Methylen- oder Brommethylbromid wurde als Pestizid zur Reinigung von Böden verwendet, insbesondere zur Beseitigung parasitärer Nematoden wie Hakenwürmer..
Die Verwendung der meisten bromhaltigen Verbindungen wurde jedoch aufgrund ihrer zerstörerischen Wirkung auf die Ozonschicht verworfen..
Quecksilberemissionskontrolle
In einigen Pflanzen wird Brom verwendet, um die Emission von Quecksilber, einem sehr giftigen Metall, zu reduzieren..
Fotografie
Silberbromid wird neben Silberiodid und Silberchlorid als lichtempfindliche Verbindung in fotografischen Emulsionen verwendet.
Therapeutische Wirkungen
Kaliumbromid sowie Lithiumbromid wurden im 19. und frühen 20. Jahrhundert als allgemeine Beruhigungsmittel verwendet. Bromide in Form einfacher Salze werden in einigen Ländern immer noch als Antikonvulsiva verwendet.
Die US-amerikanische FDA genehmigt jedoch heute nicht die Verwendung von Brom zur Behandlung von Krankheiten..
Feuerdämmend
Brom wird durch Flammen in Bromwasserstoffsäure umgewandelt, die die während des Feuers auftretende Oxidationsreaktion stört und deren Auslöschung verursacht. Bromhaltige Polymere werden zur Herstellung feuerhemmender Harze verwendet.
Lebensmittelzusatzstoff
Dem Mehl wurden Spuren von Kaliumbromat zugesetzt, um das Kochen zu verbessern.
Reagenzien und chemische Zwischenprodukte
Bromwasserstoff wird als Reduktionsmittel und Katalysator für organische Reaktionen verwendet. Brom wird als chemisches Zwischenprodukt bei der Herstellung von Arzneimitteln, Hydraulikflüssigkeiten, Kühlmitteln, Luftentfeuchtern und in Lockenwicklern verwendet.
Es findet auch Verwendung bei der Herstellung von Bohrflüssigkeiten, Produkten zur Wasserdesinfektion, Bleichmitteln, Oberflächendesinfektionsmitteln, Farbstoffen, Kraftstoffadditiven usw..
Biologische Wirkung
Eine 2014 durchgeführte Studie zeigt, dass Brom ein notwendiger Cofaktor für die Biosynthese von Kollagen IV ist, was Brom zu einem wesentlichen Element für die Entwicklung von tierischem Gewebe macht. Es gibt jedoch keine Informationen über die Folgen eines Defizits des Elements.
Wo befindet es sich?
Brom wird kommerziell aus Salzminen und tiefen Solegruben gewonnen, die im Bundesstaat Arkansas und im Great Salt Lake von Utah, beide in den USA, gefunden wurden. Diese letzte Sole hat eine Bromkonzentration von 0,5%.
Um das Brom zu extrahieren, wird das heiße gasförmige Chlor zu der Salzlösung gegeben, um die Bromidionen in der Lösung zu oxidieren und das elementare Brom zu sammeln..
Das Tote Meer an der Grenze zwischen Jordanien und Israel ist ein geschlossenes Meer unterhalb des Meeresspiegels, wodurch es eine sehr hohe Salzkonzentration aufweist.
Brom und Kali werden dort kommerziell durch Verdampfen des salzreichen Wassers aus dem Toten Meer gewonnen. In diesem Meer kann die Bromkonzentration 5 g / l erreichen.
Es kommt auch in hohen Konzentrationen in einigen heißen Quellen vor. Brominit ist beispielsweise ein Silberbromidmineral, das in Bolivien und Mexiko vorkommt..
Risiken
Brom in flüssigem Zustand ist ätzend für menschliches Gewebe. Die größte Gefahr für den Menschen geht jedoch von Bromdämpfen und deren Einatmen aus..
Atmen in einer Umgebung mit einer Bromkonzentration von 11-23 mg / m3 erzeugt schwere Stöße. Eine Konzentration von 30-60 mg / m3 es ist extrem schädlich. In der Zwischenzeit kann eine Konzentration von 200 mg tödlich sein.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Brom. PubChem-Datenbank. CID = 23968. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8. Februar 2017). Fakten über Brom. Wiederhergestellt von: livesscience.com
- Wikipedia. (2019). Borax. Wiederhergestellt von: en.wikipedia.org
- Lenntech B. V. (2019). Brom. Wiederhergestellt von: lenntech.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.