
Beryllium Geschichte, Struktur, Eigenschaften, Verwendungen
Das Beryllium Es ist ein metallisches Element, das zur Gruppe 2 oder IIA des Periodensystems gehört. Es ist das leichteste Erdalkalimetall der Gruppe und wird durch das Symbol Be dargestellt. Sein Atom und Kation sind auch kleiner als die seiner Kongenere (Mg, Ca, Sr ...).
Aufgrund seiner ungewöhnlichen Ladungsdichte tritt dieses Metall normalerweise nicht isoliert auf. Es ist bekannt, dass etwa 30 Mineralien es enthalten, darunter: Beryll (3BeOAlzweiODER36SiOzwei2HzweiO), Bertrandit (4BeO.2SiOzwei.2HzweiO), Chrysoberyl (BeAlzweiODER4) und die Fenaquita (BezweiJa4).

Smaragd, ein Edelstein, ist eine Variante von Beryll. Reines Beryllium ist jedoch nicht so auffällig; es hat hellgraue Schimmer (oberes Bild) und wurde in Form von Samen oder Pastillen erzielt.
Beryllium hat eine Reihe charakteristischer physikalischer Eigenschaften. Es hat eine geringe Dichte; hohe thermische und elektrische Leitfähigkeiten sowie deren Wärmekapazität und Wärmeableitung; es ist kein magnetisches Metall; und hat auch eine geeignete Kombination aus Steifheit und Elastizität.
All diese Eigenschaften haben dazu geführt, dass Beryllium ein Metall mit vielen Anwendungen ist, angefangen von seiner Verwendung in Legierungen mit Kupfer zur Herstellung von Werkzeugen bis hin zu seiner Verwendung in Raketen, Flugzeugen, Automobilen, Kernreaktoren, Röntgengeräten, Resonanzkernmagneten, usw.
Beryllium hat 10 bekannte Isotope, von 5Sei ein 14Sei, der zu sein 9Sei der einzige stabile. Ebenso ist es ein sehr giftiges Metall, das insbesondere die Atemwege beeinträchtigt, so dass seine Verwendung eingeschränkt ist..
Artikelverzeichnis
- 1 Geschichte seiner Entdeckung
- 2 Struktur von Beryllium
- 3 Elektronische Konfiguration
- 4 Eigenschaften
- 4.1 Physikalische Beschreibung
- 4.2 Schmelzpunkt
- 4.3 Siedepunkt
- 4.4 Dichte
- 4.5 Atomradius
- 4.6 Kovalenter Radius
- 4.7 Atomvolumen
- 4.8 Spezifische Wärme
- 4.9 Schmelzwärme
- 4.10 Verdunstungswärme
- 4.11 Elektronegativität
- 4.12 Standardpotential
- 4.13 Schallgeschwindigkeit
- 4.14 Wärmeausdehnung
- 4.15 Wärmeleitfähigkeit
- 4.16 Chemische Eigenschaften
- 5 Anwendungen
- 5.1 Entwicklung von Werkzeugen
- 5.2 Spiegel herstellen
- 5.3 In ionisierender Strahlung
- 5.4 In Geräten zur Erzeugung von Magnetismus
- 5.5 Kernreaktoren
- 5.6 Metallschutz
- 6 Wo ist?
- 7 Risiken
- 8 Referenzen
Geschichte seiner Entdeckung
Beryllium wurde 1798 von Louis-Nicolas Vauguelin als kompositorisches Element des Minerals Beryll und als Silikat aus Aluminium und Beryllium entdeckt.
Später gelang es dem deutschen Chemiker Frederic Wöhler 1828, Beryllium durch Umsetzung von Kalium mit Berylliumchlorid in einem Platintiegel zu isolieren..
Gleichzeitig und unabhängig erreichte der französische Chemiker Antoine Bussy auch die Isolierung von Beryllium. Wöhler schlug als erster den Namen Beryllium für das Metall vor.
Es erhielt seinen heutigen Namen im Jahr 1957, da es früher als Glucinium bekannt war, aufgrund des süßen Geschmacks einiger seiner Salze. Um Verwechslungen mit anderen süß schmeckenden Verbindungen und mit einer Pflanze namens Glucin zu vermeiden, wurde beschlossen, ihren Namen in Beryllium zu ändern..
Struktur von Beryllium
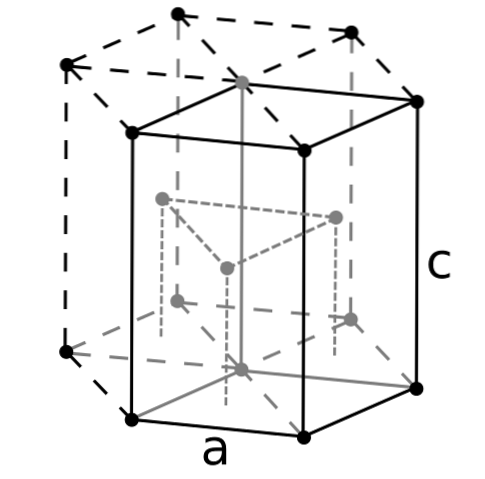
Da Beryllium das leichteste Erdalkalimetall ist, sollte erwartet werden, dass das Volumen seiner Atome das kleinste von allen ist. Berylliumatome interagieren über die Metallbindung miteinander, so dass ihr "Elektronenmeer" und die Abstoßungen zwischen den Kernen die Struktur des resultierenden Kristalls formen..
Die schwarzen Berylliumkristalle werden dann gebildet. Diese Kristalle haben eine hexagonale Struktur (oberes Bild), wobei jedes Be-Atom sechs Seitennachbarn und drei weitere in den darüber und darunter liegenden Ebenen hat..
Da die Kristalle schwarz sind, kann man sich gut vorstellen, dass die schwarzen Punkte der hexagonalen Struktur durch Berylliumatome ersetzt werden. Dies ist eine der kompaktesten Strukturen, die ein Metall annehmen kann. und es macht Sinn, dass die sehr kleinen Atome von Be so stark "zusammengedrückt" werden, um die geringste Menge an Hohlräumen oder die geringste Anzahl von Löchern zwischen ihnen zu vermeiden.
Elektronische Konfiguration
1szwei2szwei
Das entspricht 4 Elektronen, von denen 2 von Wert sind. Wenn ein Elektron zum 2p-Orbital befördert wird, haben wir zwei sp-Hybridorbitale. Somit kann es in Berylliumverbindungen lineare Geometrien geben, X-Be-X; zum Beispiel das isolierte Molekül von BeClzwei, Cl-Be-Cl.
Eigenschaften
Physische Beschreibung
Glänzender, spröder, stahlgrauer Feststoff.
Schmelzpunkt
1287 ºC.
Siedepunkt
2471 ºC.
Dichte
- 1,848 g / cm3 bei Raumtemperatur.
- 1,69 g / cm3 bis zum Schmelzpunkt (flüssiger Zustand).
Atomradio
112 Uhr.
Kovalenter Radius
90 Uhr.
Atomvolumen
5 cm3/ mol.
Spezifische Wärme
1,824 J / gmol bei 20 ° C..
Schmelzwärme
12,21 kJ / mol.
Verdunstungswärme
309 kJ / mol.
Elektronegativität
1,57 auf der Pauling-Skala.
Standardpotential
1,70 V..
Schallgeschwindigkeit
12.890 m / s.
Wärmeausdehnung
11,3 um / m K bei 25ºC.
Wärmeleitfähigkeit
200 w / m K..
Chemische Eigenschaften
Beryllium ist mit einer Schicht Berylliumoxid (BeO) beschichtet, die es bei Raumtemperatur an der Luft schützt. Die Oxidation von Beryllium erfolgt bei Temperaturen über 1000 ºC, die als Produkte Berylliumoxid und Berylliumnitrid entstehen.
Es ist auch beständig gegen die Einwirkung von Salpetersäure 15 M. Es löst sich jedoch in Salzsäure und Laugen wie Natriumhydroxid..
Anwendungen
Werkzeugherstellung
Beryllium bildet mit Kupfer, Nickel und Aluminium Legierungen. Insbesondere die Legierung mit Kupfer erzeugt Werkzeuge von großer Härte und Beständigkeit, die nur 2% des Gewichts der Legierung ausmachen..
Diese Werkzeuge erzeugen beim Auftreffen auf Eisen keine Funken, wodurch sie in Umgebungen mit einem hohen Gehalt an brennbaren Gasen eingesetzt werden können..
Aufgrund seiner geringen Dichte hat es ein geringes Gewicht, das zusammen mit seiner Steifigkeit den Einsatz in Raumflugzeugen, Raketen, Raketen und Flugzeugen ermöglicht. Die Legierung mit Beryllium wurde bei der Herstellung von Autoteilen verwendet. Es wurde auch bei der Herstellung von Federn verwendet.
Aufgrund der großen Härte, die Beryllium seinen Legierungen verleiht, wurden sie in den Bremsen von Militärflugzeugen verwendet.
Spiegel machen
Beryllium wurde aufgrund seiner Dimensionsstabilität und seiner Fähigkeit, hochglanzpoliert zu werden, bei der Herstellung von Spiegeln verwendet. Diese Spiegel werden in Satelliten und in Feuerleitsystemen verwendet. Darüber hinaus werden sie in Weltraumteleskopen eingesetzt.
In ionisierender Strahlung
Beryllium ist ein Element niedriger Dichte, daher kann es als für Röntgenstrahlen transparent angesehen werden. Diese Eigenschaft ermöglicht seine Verwendung bei der Konstruktion der Fenster der Röhren, die Röntgenstrahlen erzeugen, für die industrielle Anwendung und für die medizinische Diagnose..
Beryllium wird auch in den Fenstern von Detektoren für radioaktive Emissionen verwendet..
In Geräten zur Erzeugung von Magnetismus
Zu den Eigenschaften von Beryllium gehört, dass es kein magnetisches Element ist. Dies ermöglicht die Verwendung bei der Konstruktion von Gegenständen aus Magnetresonanzgeräten, bei denen Magnetfelder hoher Intensität erzeugt werden, wodurch jegliche Interferenz minimiert wird.
Kernreaktoren
Aufgrund seines hohen Schmelzpunktes hat es Anwendung in Kernreaktoren und Keramiken gefunden. Beryllium wird als Moderator von Kernreaktionen und als Produzent von Neutronen eingesetzt:
9Sein + 4Er (α) => 12C + n (Neutron)
Es wird geschätzt, dass für eine Million Berylliumatome, die mit α-Partikeln bombardiert werden, bis zu 30 Millionen Neutronen erzeugt werden. Genau diese Kernreaktion ermöglichte die Entdeckung des Neutrons.
James Chadwick bombardierte Berylliumatome mit α (He) -Partikeln. Der Forscher beobachtete die Freisetzung subatomarer Teilchen ohne elektrische Ladung, was zur Entdeckung von Neutronen führte.
Metallschutz
Das Hinzufügen einer Menge Beryllium auf der Oberfläche von Metallen, die oxidiert werden können, bietet ihnen einen gewissen Schutz. Beispielsweise wird die Entflammbarkeit von Magnesium verringert und der Glanz von Silberlegierungen verlängert.
Wo befindet es sich??
Beryll kommt in Pegmatit vor, das mit Glimmer, Feldspat und Quarz assoziiert ist. Unter Verwendung einer Flotationstechnik wird eine Mischung aus Beryll und Feldspat getrennt. Anschließend werden Feldspat und Beryll konzentriert und einer Behandlung mit Calciumhypochlorit unterzogen..
Gefolgt von einer Behandlung mit Schwefelsäure und Kaliumsulfonat durch Verdünnung wird die Flotation des Beryls erreicht, wobei es vom Feldspat getrennt wird.
Beryl wird mit Natriumfluorsilicat und Soda bei 770ºC behandelt, um Natriumfluorobylat, Aluminiumoxid und Siliciumdioxid zu bilden. Berylliumhydroxid wird dann mit Natriumhydroxid aus der Natriumfluoroberylatlösung ausgefällt.
Berylliumfluorid wird durch Umsetzen von Berylliumhydroxid mit Ammoniakhydrogenfluorid unter Bildung von Ammoniumtetrafluroberylat gebildet. Dies wird erhitzt, um Berylliumfluorid zu bilden, das heiß mit Magnesium behandelt wird, um das Beryllium zu isolieren..
Risiken
Beryllium als feinteiliges Metall in Form von Lösungen, trockenem Pulver oder Rauch ist sehr giftig und kann Dermatitis verursachen. Die größte Toxizität wird jedoch durch Inhalation erzeugt.
Beryllium kann zunächst eine Überempfindlichkeit oder Allergie auslösen, die sich zu Berylliose oder chronischer Berylliumkrankheit (CBD) entwickeln kann. Dies ist eine schwere Krankheit, die durch eine Abnahme der Lungenkapazität gekennzeichnet ist.
Akute Krankheit ist selten. Bei chronischen Erkrankungen bilden sich im gesamten Körper Granulome, insbesondere in der Lunge. Chronische Berylliose verursacht fortschreitende Atemnot, Husten und allgemeine Schwäche (Asthenie)..
Akute Berylliose kann tödlich sein. Bei der Berylliose tritt der fortschreitende Verlust der Atemfunktion auf, da der Gasfluss in den Atemwegen behindert wird und die Sauerstoffversorgung des arteriellen Blutes abnimmt.
Verweise
- Königliche Gesellschaft für Chemie. (2019). Beryllium. Wiederhergestellt von: rsc.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Beryllium. PubChem-Datenbank. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15. März 2019). Beryllium Fakten. Wiederhergestellt von :oughtco.com
- Wikipedia. (2019). Beryllium. Wiederhergestellt von: en.wikipedia.org
- Lenntech B. V. (2019). Beryllium-Be. Wiederhergestellt von: lenntech.com
- Materio Corporation. (2019). Erfahren Sie mehr über das Element Beryllium Wiederhergestellt von: beryllium.com
- D. Michaud. (2016, 12. April). Problem der Verarbeitung und Extraktion von Beryllium. 911 Metallurge. Wiederhergestellt von: 911metallurgist.com
- Timothy P. Hanusa. (5. Januar 2016). Beryllium. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Lee S. Newman. (2014). Beryllium-Krankheit. MSD-Handbuch. Wiederhergestellt von: msdmanuals.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.