
Benzol Geschichte, Struktur, Eigenschaften, Derivate, Verwendungen
Das Benzol Es ist eine organische Verbindung, die aus einem der einfachsten aromatischen Kohlenwasserstoffe von allen besteht. Seine chemische Formel lautet C.6H.6, von denen bekannt ist, dass das Verhältnis zwischen Kohlenstoff und Wasserstoff gleich 1 ist; Das heißt, für jeden Kohlenstoff ist ein Wasserstoff daran gebunden.
Obwohl sein physikalisches Erscheinungsbild das einer farblosen Flüssigkeit ist, kommt es natürlich in Erdöl und Erdölprodukten vor. Sein Geruch ist sehr charakteristisch, da er einer Mischung aus Leim, Bitumen und Benzin ähnelt. Andererseits ist es eine flüchtige und brennbare Flüssigkeit.

Das Bild oben zeigt einen Behälter oder eine Flasche mit Benzol, vermutlich von nicht analytischer Reinheit. Wenn sie nicht bedeckt wären, würden sich die Benzoldämpfe sofort im gesamten Labor ausbreiten. Aus diesem Grund wird diese Flüssigkeit, die üblicherweise als einfaches Lösungsmittel verwendet wird, in einem Abzug gehandhabt..
Sein seine Formel C.6H.6, Chemiker des 19. Jahrhunderts schlugen zahlreiche mögliche Strukturen vor, die dem C / H-Verhältnis von 1 entsprechen würden. Nicht nur das, sondern auch das Benzolmolekül musste spezielle Bindungen aufweisen, so dass seine ungewöhnliche Stabilität gegenüber Additionsreaktionen erklärt werden konnte; typisch für Alkene und Polyene.
So stellten ihre Verbindungen ein Rätsel für die damaligen Chemiker dar; bis die Eigenschaft angerufen Aromatizität. Bevor Benzol als Hexacyclotrien (mit drei C = C-Bindungen) betrachtet wurde, ist es viel mehr als das, und es ist eines der vielen Beispiele für Synergien in der Chemie.
In der organischen Chemie ist Benzol ein klassisches Symbol, die strukturelle Basis für mehrere polyaromatische Verbindungen. Endlose Derivate werden aus ihrem Hexagon durch aromatische elektrophile Substitution erhalten; ein Ring, aus dessen Kanten die Struktur gewebt wird, die neue Verbindungen definiert.
Tatsächlich sind seine Derivate auf die enormen industriellen Verwendungen zurückzuführen, für die sie Benzol als Rohstoff benötigen. Von der Herstellung von Klebstoffen und Textilfasern bis hin zu Kunststoffen, Kautschuken, Pigmenten, Arzneimitteln und Sprengstoffen. Andererseits kommt Benzol natürlich in Vulkanen, Waldbränden, Benzin und Zigarettenrauch vor..
Artikelverzeichnis
- 1 Geschichte
- 1.1 Entdeckung und Namen
- 1.2 Industrieproduktion
- 1.3 Historische Strukturen
- 2 Struktur von Benzol
- 2.1 Resonanz
- 2.2 Kristalle
- 3 Eigenschaften
- 3.1 Molekularmasse
- 3.2 Aussehen
- 3.3 Siedepunkt
- 3.4 Schmelzpunkt
- 3.5 Flammpunkt
- 3.6 Selbstentzündungstemperatur
- 3.7 Dichte
- 3.8 Löslichkeit
- 3.9 Dampfdichte
- 3.10 Dampfdruck
- 3.11 Verbrennungswärme
- 3.12 Verdampfungswärme
- 3.13 Oberflächenspannung
- 3.14 Brechungsindex
- 4 Derivate
- 5 Verwendungen
- 6 Nomenklatur
- 7 Toxizität
- 8 Referenzen
Geschichte
Entdeckung und Namen
Seine Entdeckung geht auf das Jahr 1825 zurück, das normalerweise Michael Faraday zugeschrieben wird, als er ein verbleibendes Ölprodukt des für die Beleuchtung verwendeten Gases sammelte und mit ihm experimentierte. Diese Flüssigkeit enthielt ein C / H-Verhältnis nahe 1, weshalb er es "vergasten Wasserstoff" nannte..
Der Chemiker Auguste Laurent nannte den seltsamen Kohlenwasserstoff "Pheno", abgeleitet vom griechischen Wort "Phaínein'was hell bedeutet (weil es nach dem Verbrennen des Gases erhalten wurde). Dieser Name wurde jedoch von der wissenschaftlichen Gemeinschaft nicht akzeptiert und setzte sich nur als "Phenyl" durch, um sich auf das von Benzol abgeleitete Radikal zu beziehen.
Aus Benzingummi gelang es dem Chemiker Eilhard Mitscherlich neun Jahre später, die gleiche Verbindung herzustellen; Daher gab es eine andere Quelle für denselben Kohlenwasserstoff, den er als "Benzin" taufte. Sie berücksichtigten jedoch auch nicht den passenden Namen, vorausgesetzt, es handelte sich um ein Alkaloid wie Chinin..
Daher ersetzten sie den Namen "Benzin" durch "Benzol". Es gab jedoch wieder Widersprüche und Unstimmigkeiten infolge des Begriffs "Benzol", der den Kohlenwasserstoff für einen Alkohol verwirrte. Damals wurde der Name "Benzol" geboren, der erstmals in Frankreich und England verwendet wurde..
Industrielle Produktion
Weder Beleuchtungsgas noch Benzingummi waren geeignete Quellen für die Erzeugung von Benzol in großem Maßstab. Charles Mansfield gelang es 1845 in Zusammenarbeit mit August Wilhelm von Hofmann, Benzol (zwanzig Jahre nach seiner Entdeckung) aus Kohlenteer, einem Nebenprodukt der Koksproduktion, zu isolieren..
So begann die industrielle Produktion von Benzol aus Kohlenteer. Die Verfügbarkeit von Benzol in großen Mengen erleichterte die Untersuchung seiner chemischen Eigenschaften und ermöglichte die Beziehung zu anderen Verbindungen mit ähnlichen Reaktivitäten. August Wilhelm von Hofmann selbst prägte das Wort "aromatisch" für Benzol und verwandte Verbindungen.
Historische Strukturen
August Kekulés Traum
Friedrich August Kekulé wird die hexagonale und zyklische Struktur von Benzol um das Jahr 1865 zugeschrieben, die aus einem seltsamen Traum mit Uroboros hervorgeht, der Schlange, die sich durch Zeichnen eines Kreises in den Schwanz beißt. Daher glaubte er, dass Benzol als hexagonaler Ring betrachtet werden könnte, und andere Chemiker schlugen mögliche Strukturen vor, die nachstehend gezeigt werden:

Einige der höheren Strukturen könnten für die Stabilität von Benzol verantwortlich sein.
Buch, Ringe und Prisma
Beachten Sie, dass die dritte Struktur nicht einmal ein Ring ist, sondern ein dreieckiges Prisma, das 1869 von Albert Ladenburg vorgeschlagen wurde. zu seiner Linken eines in Form eines offenen Buches, das 1867 von Sir James Dewar vorgeschlagen wurde; und rechts davon einer mit allen Wasserstoffatomen, die auf die Mitte des Rings gerichtet sind, vorgeschlagen von Henry Edward Armstrong im Jahr 1887.
Die erste Struktur, die Adolf Karl Ludwig Claus 1867 vorschlug, ist ebenfalls recht eigenartig, da die C-C-Verbindungen gekreuzt sind. Und der letzte war Kekulés "Serpentinenring", von dem 1865 geträumt wurde.
Was war der "Gewinner"? Die fünfte Struktur (von links nach rechts) wurde 1899 von Johannes Thiele vorgeschlagen.
In dieser Studie wurde erstmals der Resonanzhybrid betrachtet, der die beiden Kekulé-Strukturen kombinierte (den ersten Ring rechts drehen, um ihn zu beobachten) und die Delokalisierung von Elektronen und damit die bis dahin ungewöhnliche Stabilität von außerordentlich erklärte das Benzol.
Struktur von Benzol
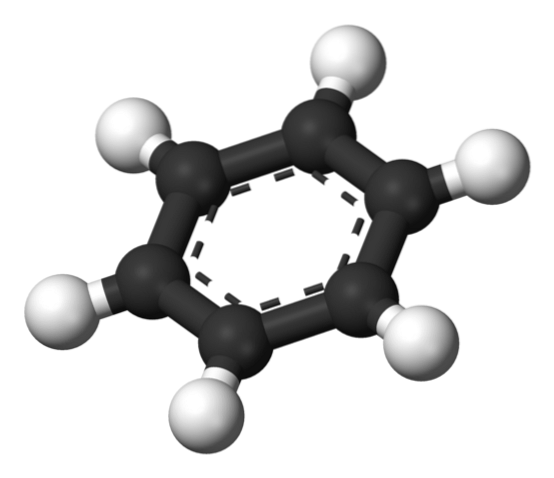
Oben ist die von Thiele vorgeschlagene Struktur anhand eines Modells von Kugeln und Balken dargestellt..
Das Benzolmolekül ist flach, wobei die Wasserstoffatome von den Seiten des Rings nach außen zeigen. Alle Kohlenstoffatome weisen eine sp-Hybridisierung aufzwei, mit einem Orbital p verfügbar, um das aromatische System zu etablieren, in dem sich sechs Elektronen delokalisieren.
Diese Kohlenstoffe spzwei sind elektronegativer als Wasserstoffatome, und daher ziehen die ersteren der letzteren die elektronische Dichte zurück (C.sp2δ--H.δ+). Folglich hat das Zentrum des Rings eine höhere Elektronenkonzentration als seine Seiten..
Genauer gesagt kann das aromatische System als eine elektronische Wolke oder ein elektronisches Kissen dargestellt werden, das auf beiden Seiten des hexagonalen Rings erweitert ist; und in der Mitte an den Seiten oder Kanten ein elektronischer Mangel aus Wasserstoffatomen mit positiver Teilladung.
Dank dieser Verteilung elektrischer Ladungen können Benzolmoleküle durch Dipol-Dipol-Kräfte miteinander interagieren. H-Atomeδ+ werden vom Duftzentrum eines benachbarten Rings angezogen (dies wird unten dargestellt).
Die aromatischen Zentren können auch übereinander gestapelt werden, um die Induktion der augenblicklichen Dipole zu begünstigen..
Resonanz

Die beiden Kekulé-Strukturen sind oben im Bild und darunter der Resonanzhybrid dargestellt. Da die beiden Strukturen immer wieder gleichzeitig auftreten, wird der Hybrid durch einen in der Mitte gezeichneten Kreis dargestellt (ähnlich dem eines "hexagonalen Donuts")..
Der Hybridkreis ist wichtig, weil er den aromatischen Charakter von Benzol (und dem vieler anderer Verbindungen) anzeigt. Darüber hinaus weist er darauf hin, dass die Verknüpfungen weder so lang wie C-C noch so kurz wie C = C sind; aber die Länge derselben liegt zwischen beiden Extremen. Somit wird Benzol nicht als Polyen angesehen.
Das Vorgenannte wurde durch Messung der Länge der C-C-Bindungen (139 pm) von Benzol demonstriert, die etwas länger sind als die C-H-Bindungen (109 pm)..
Kristalle
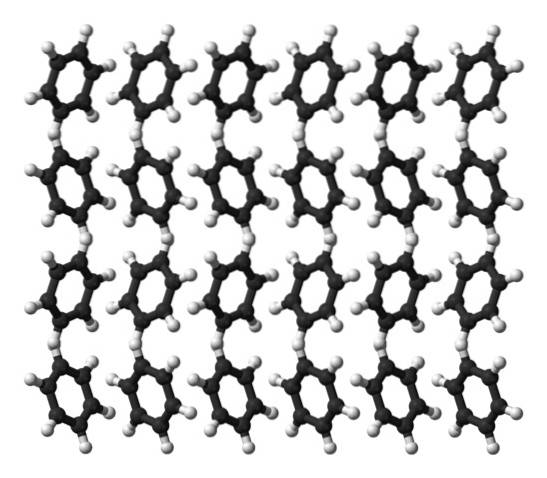
Benzol ist bei Raumtemperatur eine Flüssigkeit. Aufgrund seiner intermolekularen Kräfte kann es seine Moleküle in einer Flüssigkeit, die bei 80 ° C siedet, zusammenhalten, obwohl es kein so ausgeprägtes Dipolmoment aufweist. Wenn die Temperatur unter 5ºC fällt, beginnt Benzol zu gefrieren, und so werden die entsprechenden Kristalle erhalten..
Benzolringe können in ihrem Feststoff definierte Strukturmuster annehmen. Ihre Dipole bewirken, dass sie nach links oder rechts "kippen" und Reihen bilden, die von einer orthorhombischen Einheitszelle reproduziert werden können. Somit sind Benzolkristalle orthorhombisch.
Beachten Sie im oberen Bild, dass das Kippen der Ringe die Wechselwirkungen zwischen dem H begünstigtδ+ und aromatische Zentren, die in früheren Unterabschnitten erwähnt wurden.
Eigenschaften
Molekulare Masse
78,114 g / mol.
Aussehen
Farblose Flüssigkeit mit benzinartigem Geruch.
Siedepunkt
80ºC.
Schmelzpunkt
5,5ºC.
Zündpunkt
-11ºC (geschlossene Tasse).
Selbstentzündungstemperatur
497,78ºC.
Dichte
0,8765 g / ml bei 20 ° C..
Löslichkeit
Ein Liter kochendes Wasser kann 3,94 g Benzol kaum lösen. Aufgrund seines unpolaren Charakters ist es mit Wasser praktisch nicht mischbar. Es ist jedoch mit anderen Lösungsmitteln wie Ethanol, Ethern, Aceton, Ölen, Chloroform, Tetrachlorkohlenstoff usw. mischbar..
Wasserdampfdichte
2,8 relativ zu Luft (d. H. Fast dreimal so dicht).
Dampfdruck
94,8 mm Hg bei 25 ° C..
Verbrennungswärme
-3267,6 kJ / mol (für flüssiges Benzol).
Verdampfungswärme
33,83 kJ / mol.
Oberflächenspannung
28,22 mN / m bei 25 ° C..
Brechungsindex
1,5011 bei 20ºC.
Derivate
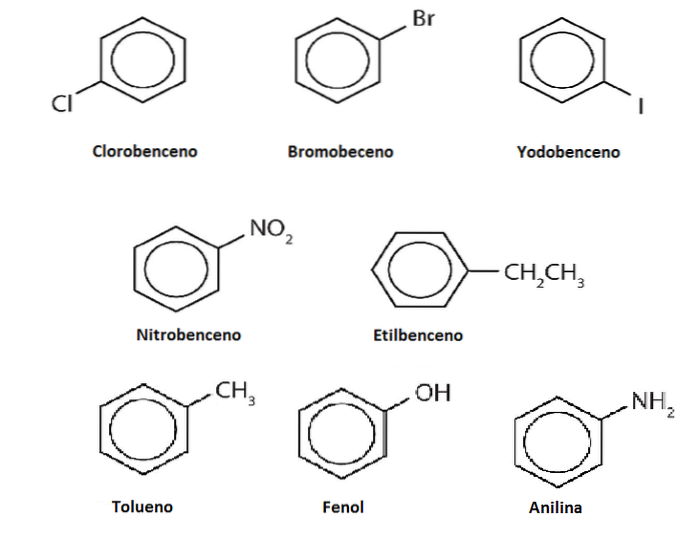
Die Wasserstoffatome von Benzol können durch andere Gruppen oder Atome ersetzt werden. Es kann eine oder mehrere Substitutionen geben, die den Substitutionsgrad erhöhen, bis keiner der ursprünglichen sechs Wasserstoffatome mehr vorhanden ist.
Nehmen wir zum Beispiel Benzol als Ph-H an, wobei H einer seiner sechs Wasserstoffatome ist. Wenn man bedenkt, dass das Zentrum des Rings eine höhere Elektronendichte aufweist, zieht es Elektrophile an, die den Ring angreifen, um H in einer Reaktion zu ersetzen, die als elektrophile aromatische Substitution (SEAr) bezeichnet wird..
Wenn dieses H durch ein OH ersetzt wird, haben wir das Ph-OH, Phenol; durch einen CH ersetzt werden3, Ph-CH3, Toluol; wenn es NH istzwei, Ph-NHzwei, Anilin; oder wenn es der CH istzweiCH3, Ph-CHzweiCH3, Ethylbenzol.
Die Derivate können gleich oder toxischer als Benzol sein oder im Gegenteil so komplex werden, dass sie eine wünschenswerte pharmakologische Wirkung haben..
Anwendungen
Es ist ein gutes Lösungsmittel für eine Vielzahl von Verbindungen, die beispielsweise in Farben, Lacken, Klebstoffen und Beschichtungen enthalten sind.
Es kann auch Öle, Fette oder Wachse lösen, weshalb es als Extraktionslösungsmittel für Essenzen verwendet wurde. Diese Eigenschaft wurde 1903 von Ludwig Roselius zur Entkoffeinierung von Kaffee genutzt, ein Vorgang, der aufgrund der Toxizität von Benzol nicht mehr angewendet wird. Ebenso wurde es in der Vergangenheit zum Entfetten von Metallen verwendet.
Bei einer seiner klassischen Anwendungen wirkt es nicht als Lösungsmittel, sondern als Additiv: Erhöht die Oktanzahl von Benzin und ersetzt zu diesem Zweck Blei..
Derivate von Benzol können unterschiedliche Verwendungszwecke haben; Einige dienen als Pestizide, Schmiermittel, Reinigungsmittel, Kunststoffe, Sprengstoffe, Parfums, Farbstoffe, Klebstoffe, Drogen usw. Wenn ein Benzolring in seiner Struktur beobachtet wird, ist es sehr wahrscheinlich, dass seine Synthese von Benzol aus begonnen hat.
Zu den wichtigsten Derivaten zählen: Cumol, Xylol, Anilin, Phenol (zur Synthese von Phenolharzen), Benzoesäure (Konservierungsmittel), Cyclohexan (zur Synthese von Nylon), Nitrobenzol, Resorcin und Ethylbenzol.
Nomenklatur
Die Nomenklatur der Benzolderivate variiert in Abhängigkeit vom Substitutionsgrad, den Substituentengruppen und ihren relativen Positionen. Somit kann Benzol Mono-, Di-, Tri-, Tetra- usw. Substitutionen eingehen
Wenn die beiden Gruppen an benachbarte Kohlenstoffe gebunden sind, wird die Bezeichnung "ortho" verwendet. wenn es einen Kohlenstoff gibt, der sie trennt, 'meta'; und wenn sich die Kohlenstoffe in entgegengesetzten Positionen befinden, 'para'.
Die folgenden Bilder zeigen Beispiele für Benzolderivate mit ihren jeweiligen Namen, die von der IUPAC geregelt werden. Sie werden auch von gebräuchlichen oder traditionellen Namen begleitet.
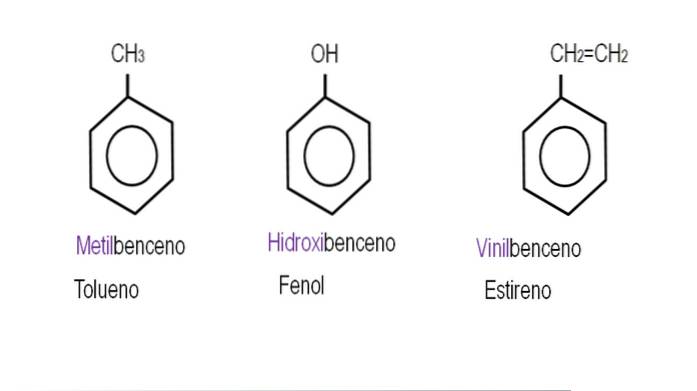
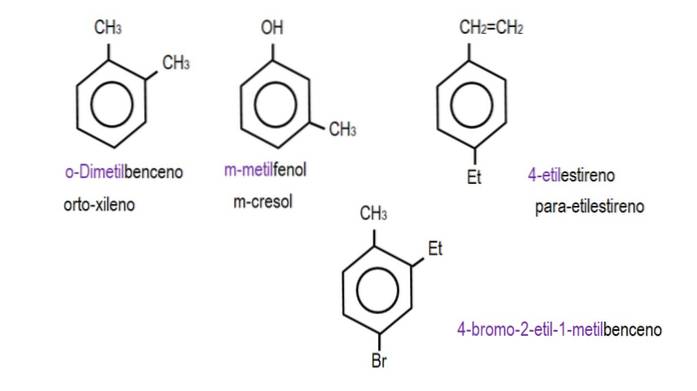
Beachten Sie, dass in trisubstituiertem Benzol die ortho-, para- und meta-Indikatoren nicht mehr nützlich sind..
Toxizität
Benzol ist eine Verbindung, die mit Vorsicht behandelt werden muss. Aufgrund seines besonderen Geruchs können Erstickungsgefahr, Schwindel, Kopfschmerzen, Zittern, Schläfrigkeit, Übelkeit und sogar der Tod (bei hoher Exposition) die unmittelbaren negativen Auswirkungen sein. Bei Einnahme kann es zusätzlich zu den oben genannten zu starken Magenschmerzen und Krampfanfällen kommen..
Darüber hinaus sind die Langzeiteffekte bei ständiger Exposition gegenüber dieser Flüssigkeit krebserregend. erhöht die Wahrscheinlichkeit, dass die Person an irgendeiner Art von Krebs leidet, insbesondere an Blutkrebs: Leukämie.
Im Blut kann es die Konzentration roter Blutkörperchen verringern, was zu Anämie führt, und auch das Knochenmark und die Leber beeinträchtigen, wo es vom Körper aufgenommen wird, um noch giftigere Benzolderivate zu erzeugen. zum Beispiel Hydroxychinon. Es reichert sich auch in den Nieren, im Herzen, in der Lunge und im Gehirn an..
Verweise
- Morrison, R.T. und Boyd, R. N. (1987). Organische Chemie. (5. Auflage). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organische Chemie. (6. Auflage). McGraw-Hill, Interamerica, Herausgeber S.A..
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Benzol. PubChem-Datenbank. CID = 241, wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzol. Wiederhergestellt von: en.wikipedia.org
- Garcia Nissa. (2019). Was ist Benzol? - Verwendung, Struktur & Formel. Studie. Wiederhergestellt von: study.com
- Zentren für die Kontrolle und Prävention von Krankheiten. (04. April 2018). Fakten über Benzol. Wiederhergestellt von: Emergency.cdc.gov
- Weltgesundheitsorganisation. (2010). Exposition gegenüber Benzol: ein großes Problem für die öffentliche Gesundheit. [PDF]. Wiederhergestellt von: who.int
- Fernández Germán. (s.f.). Probleme mit der Benzol-Nomenklatur. Organische Chemie. Wiederhergestellt von: quimicaorganica.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.