
Charakteristische Grundlagen und Beispiele

Das Basen Es sind all jene chemischen Verbindungen, die Protonen aufnehmen oder Elektronen abgeben können. In der Natur oder künstlich gibt es sowohl anorganische als auch organische Basen. Daher kann sein Verhalten für viele ionische Moleküle oder Feststoffe vorhergesagt werden..
Was eine Base jedoch von den übrigen chemischen Substanzen unterscheidet, ist ihre ausgeprägte Tendenz, Elektronen abzugeben, im Vergleich zu beispielsweise Spezies mit geringer Elektronendichte. Dies ist nur möglich, wenn sich das elektronische Paar befindet. Infolgedessen haben Basen elektronenreiche Regionen δ-.

Welche organoleptischen Eigenschaften ermöglichen die Identifizierung der Basen? Es handelt sich in der Regel um ätzende Substanzen, die durch körperlichen Kontakt schwere Verbrennungen verursachen. Gleichzeitig haben sie eine seifige Note und lösen Fette leicht auf. Darüber hinaus sind seine Aromen bitter.
Wo sind sie im täglichen Leben? Eine kommerzielle und routinemäßige Quelle für Stiftungen sind Reinigungsprodukte, von Reinigungsmitteln bis hin zu Handseifen. Aus diesem Grund kann das Bild von in der Luft schwebenden Blasen helfen, sich an die Basen zu erinnern, obwohl sich hinter ihnen viele physikalisch-chemische Phänomene befinden..
Viele Basen weisen völlig unterschiedliche Eigenschaften auf. Zum Beispiel haben einige üble und starke Gerüche, wie organische Amine. Andere hingegen, wie Ammoniak, dringen ein und reizen. Sie können auch farblose Flüssigkeiten oder ionische weiße Feststoffe sein..
Allen Basen ist jedoch eines gemeinsam: Sie reagieren mit Säuren unter Bildung löslicher Salze in polaren Lösungsmitteln wie Wasser..
Artikelverzeichnis
- 1 Eigenschaften der Basen
- 1.1 Physikalische Eigenschaften
- 1.2 Stärke einer Basis
- 1,3 pH größer als 7
- 1.4 Fähigkeit, Säuren zu neutralisieren
- 1.5 Oxidreduktionskapazität
- 1.6 OH freigeben-
- 1.7 Sie haben Stickstoffatome oder Substituenten, die die Elektronendichte anziehen
- 2 Beispiele für Basen
- 2,1 NaOH
- 2.2 CH3OCH3
- 2.3 Alkalihydroxide
- 2.4 Organische Basen
- 2,5 NaHCO 3
- 3 Referenzen
Eigenschaften der Basen

Welche spezifischen Eigenschaften sollten alle Basen haben, abgesehen von dem, was bereits erwähnt wurde? Wie können sie Protonen aufnehmen oder Elektronen spenden? Die Antwort liegt in der Elektronegativität der Atome des Moleküls oder Ions; und unter allen ist Sauerstoff der vorherrschende, insbesondere wenn er als Hydroxylion OH gefunden wird-.
Physikalische Eigenschaften
Die Basen haben einen sauren Geschmack und sind mit Ausnahme von Ammoniak geruchlos. Seine Textur ist rutschig und kann die Farbe von Lackmuspapier in Blau, Methylorange in Gelb und Phenolphthalein in Lila ändern..
Stärke einer Basis
Basen werden in starke und schwache Basen eingeteilt. Die Stärke einer Base ist mit ihrer Gleichgewichtskonstante verbunden, daher werden diese Konstanten im Fall von Basen als Basizitätskonstanten Kb bezeichnet.
Daher haben starke Basen eine große Basizitätskonstante, so dass sie dazu neigen, sich vollständig zu dissoziieren. Beispiele für diese Säuren sind Alkalien wie Natrium- oder Kaliumhydroxid, deren Basizitätskonstanten so groß sind, dass sie in Wasser nicht gemessen werden können..
Andererseits ist eine schwache Base eine Base, deren Dissoziationskonstante niedrig ist, so dass sie sich im chemischen Gleichgewicht befindet.
Beispiele hierfür sind Ammoniak und Amine, deren Säurekonstanten in der Größenordnung von 10 liegen-4. 1 zeigt die verschiedenen Säurekonstanten für verschiedene Basen.
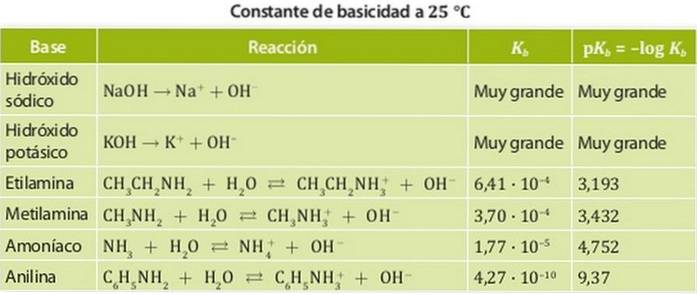
pH größer als 7
Die pH-Skala misst die Alkalität oder den Säuregehalt einer Lösung. Die Skala reicht von Null bis 14. Ein pH-Wert von weniger als 7 ist sauer. Ein pH-Wert von mehr als 7 ist basisch. Mittelpunkt 7 repräsentiert einen neutralen pH. Eine neutrale Lösung ist weder sauer noch alkalisch.
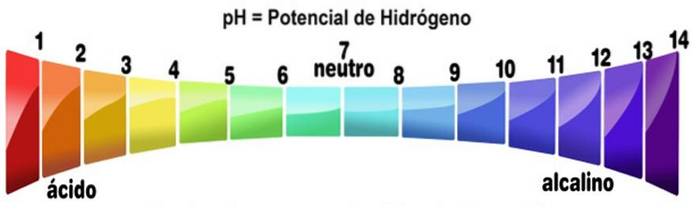
Die pH-Skala wird als Funktion der Konzentration von H erhalten+ in der Lösung und ist umgekehrt proportional dazu. Basen erhöhen durch Verringern der Protonenkonzentration den pH-Wert einer Lösung.
Fähigkeit, Säuren zu neutralisieren
Arrhenius schlägt in seiner Theorie vor, dass Säuren, indem sie Protonen erzeugen können, mit der Hydroxylgruppe der Basen unter Bildung von Salz und Wasser auf folgende Weise reagieren:
HCl + NaOH → NaCl + H.zweiODER.
Diese Reaktion wird als Neutralisation bezeichnet und ist die Grundlage der als Titration bezeichneten Analysetechnik..
Oxidreduktionskapazität
Aufgrund ihrer Fähigkeit, geladene Spezies zu produzieren, werden Basen als Medium für den Elektronentransfer bei Redoxreaktionen verwendet..
Basen neigen auch zur Oxidation, da sie freie Elektronen abgeben können..
Die Basen enthalten OH-Ionen. Sie können Elektronen spenden. Aluminium ist ein Metall, das mit Basen reagiert.
2Al + 2NaOH + 6HzweiO → 2NaAl (OH)4+3Hzwei
Sie korrodieren nicht viele Metalle, da Metalle dazu neigen, Elektronen eher zu verlieren als aufzunehmen, aber Basen sind gegenüber organischen Substanzen, wie denen, aus denen die Zellmembran besteht, stark ätzend..
Diese Reaktionen sind normalerweise exotherm und verursachen bei Hautkontakt schwere Verbrennungen. Daher muss diese Art von Substanz mit Vorsicht behandelt werden. Abbildung 3 ist der Sicherheitsindikator, wenn ein Stoff ätzend ist.

Sie setzen OH frei-
Zunächst die OH- Es kann in vielen Verbindungen vorhanden sein, hauptsächlich in Metallhydroxiden, da es in Gesellschaft von Metallen dazu neigt, Protonen zu "schnappen", um Wasser zu bilden. Somit kann eine Base jede Substanz sein, die dieses Ion in Lösung durch ein Löslichkeitsgleichgewicht freisetzt:
M (OH)zwei <=> M.zwei+ + 2OH-
Wenn das Hydroxid sehr löslich ist, verschiebt sich das Gleichgewicht vollständig nach rechts von der chemischen Gleichung und wir sprechen von einer starken Base. M (OH)zwei , Stattdessen ist es eine schwache Base, da es seine OH-Ionen nicht vollständig freisetzt- im Wasser. Einmal die OH- produziert kann jede Säure neutralisieren, die sich in der Nähe befindet:
Oh- + HA => A.- + H.zweiODER
Und so die OH- deprotoniert Säure HA, um sich in Wasser umzuwandeln. Warum? Weil das Sauerstoffatom sehr elektronegativ ist und aufgrund der negativen Ladung auch eine überschüssige Elektronendichte aufweist.
O hat drei Paare freier Elektronen und kann eines davon an das teilweise positiv geladene H-Atom δ + abgeben. Ebenso begünstigt die große Energiestabilität des Wassermoleküls die Reaktion. Mit anderen Worten: H.zweiOder es ist viel stabiler als HA, und wenn dies zutrifft, tritt die Neutralisationsreaktion auf.
Basen konjugieren
Und was ist mit OH?- bereits-? Beide sind Basen, mit dem Unterschied, dass A.- ist der konjugierte Base Säure HA. Darüber hinaus ist A.- ist eine viel schwächere Base als OH-. Von hier aus wird folgende Schlussfolgerung gezogen: Eine Base reagiert, um eine schwächere zu erzeugen.
Base Stark + Acid Stark => Basis Schwach + Acid Schwach
Wie aus der allgemeinen chemischen Gleichung ersichtlich ist, gilt dies auch für Säuren.
Konjugierte Base A.- kann ein Molekül in einer als Hydrolyse bekannten Reaktion deprotonieren:
ZU- + H.zweiODER <=> HA + OH-
Im Gegensatz zu OH-, es stellt ein Gleichgewicht her, wenn es mit Wasser neutralisiert wird. Wieder ist es, weil A.- Es ist eine viel schwächere Base, aber genug, um eine Änderung des pH-Werts der Lösung zu bewirken.
Daher sind alle Salze, die A enthalten- Sie sind als Basissalze bekannt. Ein Beispiel hierfür ist Natriumcarbonat, NazweiCO3, welches nach dem Auflösen die Lösung durch die Hydrolysereaktion basisch macht:
CO3zwei- + H.zweiODER <=> HCO3- + Oh-
Sie haben Stickstoffatome oder Substituenten, die die Elektronendichte anziehen
Eine Base besteht nicht nur aus ionischen Feststoffen mit OH-Anionen- In ihrem Kristallgitter können sie auch andere elektronegative Atome wie Stickstoff haben. Diese Arten von Basen gehören zur organischen Chemie und gehören zu den häufigsten Aminen.
Was ist die Amingruppe? R-NHzwei. Am Stickstoffatom befindet sich ein ungeteiltes elektronisches Paar, das ebenso wie das OH kann-, ein Wassermolekül deprotonieren:
R-NHzwei + H.zweiODER <=> RNH3+ + Oh-
Das Gleichgewicht ist stark nach links verschoben, da Amin, obwohl basisch, viel schwächer als OH ist-. Beachten Sie, dass die Reaktion der für das Ammoniakmolekül angegebenen ähnlich ist:
NH3 + H.zweiODER <=> NH4+ + Oh-
Nur Amine können das Kation NH nicht richtig bilden4+;; obwohl RNH3+ ist das Ammoniumkation mit einer Monosubstitution.
Und kann es mit anderen Verbindungen reagieren? Ja, bei jedem, der ausreichend sauren Wasserstoff hat, auch wenn die Reaktion nicht vollständig abläuft. Das heißt, nur ein sehr starkes Amin reagiert, ohne ein Gleichgewicht herzustellen. Ebenso können Amine ihr Elektronenpaar an andere Spezies als H abgeben (wie Alkylradikale: -CH)3).
Basen mit aromatischen Ringen
Amine können auch aromatische Ringe haben. Wenn sein Elektronenpaar im Ring "verloren" gehen kann, weil der Ring die Elektronendichte anzieht, nimmt seine Basizität ab. Warum? Denn je lokalisierter das Paar innerhalb der Struktur ist, desto schneller reagiert es mit der elektronenarmen Spezies.
Zum Beispiel NH3 es ist grundlegend, weil sein Elektronenpaar nirgendwo hingehen kann. Gleiches gilt für Amine, unabhängig davon, ob sie primär sind (RNH)zwei), sekundär (R.zweiNH) oder tertiär (R.3N). Diese sind basischer als Ammoniak, da Stickstoff zusätzlich zu dem, was gerade erklärt wurde, höhere elektronische Dichten der R-Substituenten anzieht und somit δ erhöht-.
Wenn es jedoch einen aromatischen Ring gibt, kann dieses Paar in ihm in Resonanz treten, was es unmöglich macht, an der Bildung von Bindungen mit H oder anderen Spezies teilzunehmen. Daher neigen aromatische Amine dazu, weniger basisch zu sein, es sei denn, das Elektronenpaar bleibt an Stickstoff gebunden (wie beim Pyridinmolekül)..
Beispiele für Basen
NaOH
Natriumhydroxid ist eine der weltweit am häufigsten verwendeten Basen. Seine Anwendungen sind unzählig, aber unter ihnen können wir seine Verwendung zur Verseifung einiger Fette und damit zur Herstellung basischer Salze von Fettsäuren (Seifen) erwähnen..
CH3OCH3
Strukturell scheint Aceton keine Protonen aufzunehmen (oder Elektronen abzugeben), tut dies jedoch, obwohl es eine sehr schwache Base ist. Dies liegt daran, dass das elektronegative O-Atom die Elektronenwolken der CH-Gruppen anzieht.3, Hervorheben der Anwesenheit seiner zwei Elektronenpaare (: O :).
Alkalihydroxide
Alkalimetallhydroxide sind neben NaOH auch starke Basen (mit geringfügiger Ausnahme von LiOH). So gibt es unter anderem folgende Grundlagen:
-KOH: Kaliumhydroxid oder Kalilauge. Aufgrund seiner großen Entfettungskraft ist es eine der am häufigsten verwendeten Basen im Labor oder in der Industrie.
-RbOH: Rubidiumhydroxid.
-CsOH: Cäsiumhydroxid.
-FrOH: Franciumhydroxid, dessen Basizität theoretisch als eine der stärksten jemals bekannten angesehen wird.
Organische Basen
-CH3CHzweiNHzwei: Ethylamin.
-LiNHzwei: Lithiumamid. Zusammen mit Natriumamid NaNHzwei, Sie sind eine der stärksten organischen Basen. In ihnen das Amidanion NHzwei- Es ist die Base, die Wasser deprotoniert oder mit Säuren reagiert.
-CH3ONa: Natriummethoxid. Hier ist die Basis das Anion CH3ODER-, welches mit Säuren reagieren kann, um Methanol, CH zu ergeben3Oh.
-Grignard-Reagenzien: haben ein Metallatom und ein Halogen, RMX. In diesem Fall ist das Radikal R die Base, aber nicht genau, weil es einen sauren Wasserstoff wegnimmt, sondern weil es sein Elektronenpaar aufgibt, das es mit dem Metallatom teilt. Zum Beispiel: Ethylmagnesiumbromid, CH3CHzweiMgBr. Sie sind sehr nützlich in der organischen Synthese.
NaHCO3
Backpulver wird verwendet, um den Säuregehalt unter milden Bedingungen zu neutralisieren, beispielsweise im Mund als Zusatz in Zahnpasten.
Verweise
- Merck KGaA. (2018). Organische Basen. Entnommen aus: sigmaaldrich.com
- Wikipedia. (2018). Grundlagen (Chemie). Entnommen aus: es.wikipedia.org
- Chemie 1010. Säuren und Basen: Was sie sind und wo sie gefunden werden. [PDF]. Entnommen aus: cactus.dixie.edu
- Säuren, Basen und die pH-Skala. Entnommen aus: 2.nau.edu
- Die Bodner Gruppe. Definitionen von Säuren und Basen und die Rolle von Wasser. Entnommen aus: chemed.chem.purdue.edu
- Chemie LibreTexts. Grundlagen: Eigenschaften und Beispiele. Entnommen aus: chem.libretexts.org
- Shiver & Atkins. (2008). Anorganische Chemie. Auf Säuren und Basen. (vierte Edition). Mc Graw Hill.
- Helmenstine, Todd. (04. August 2018). Namen von 10 Basen. Wiederhergestellt von :oughtco.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.