
Arsen Geschichte, Struktur, Eigenschaften, Verwendungen
Das Arsen Es ist ein Halbmetall oder Metalloid, das zur Gruppe 15 oder VA des Periodensystems gehört. Es wird durch das chemische Symbol As dargestellt und seine Ordnungszahl ist 33. Es kann in drei allotropen Formen gefunden werden: gelb, schwarz und grau; Letzteres ist das einzige mit industrieller Bedeutung.
Graues Arsen ist ein spröder, metallisch aussehender Feststoff mit einer stählernen, kristallinen Farbe (Bild unten). Es verliert seinen Glanz an der Luft und bildet Arsenoxid (AszweiODER3), die beim Erhitzen einen Knoblauchgeruch abgibt. Andererseits sind seine gelben und schwarzen Allotrope molekular bzw. amorph..

Arsen kommt in der Erdkruste vor, die mit zahlreichen Mineralien verbunden ist. Im Heimatstaat kommt nur ein geringer Anteil vor, der jedoch mit Antimon und Silber in Verbindung gebracht wird.
Zu den häufigsten Mineralien, in denen Arsen enthalten ist, gehören: Realgar (As4S.4), das Orpiment (AszweiS.3), Loellingit (FeAszwei) und Enargit (Cu3Arsch4). Arsen entsteht auch als Nebenprodukt beim Schmelzen von Metallen wie Blei, Kupfer, Kobalt und Gold..
Arsenverbindungen sind toxisch, insbesondere Arsin (AsH)3). Arsen hat jedoch zahlreiche industrielle Anwendungen, einschließlich des Legierens mit Blei, das bei der Herstellung von Autobatterien verwendet wird, und des Legierens mit Gallium mit verschiedenen Anwendungen in der Elektronik..
Artikelverzeichnis
- 1 Geschichte seiner Entdeckung
- 2 Struktur von Arsen
- 2.1 Gelbes Arsen
- 2.2 Schwarzes Arsen
- 3 Elektronische Konfiguration
- 4 Eigenschaften
- 4.1 Molekulargewicht
- 4.2 Physikalische Beschreibung
- 4.3 Farbe
- 4.4 Geruch
- 4.5 Geschmack
- 4.6 Schmelzpunkt
- 4.7 Dichte
- 4.8 Löslichkeit in Wasser
- 4.9 Atomradius
- 4.10 Atomvolumen
- 4.11 Kovalenter Radius
- 4.12 Spezifische Wärme
- 4.13 Verdunstungswärme
- 4.14 Elektronegativität
- 4.15 Ionisierungsenergie
- 4.16 Oxidationsstufen
- 4.17 Stabilität
- 4.18 Zersetzung
- 4.19 Selbstentzündung
- 4.20 Härte
- 4.21 Reaktivität
- 5 Verwendungen
- 5.1 Legierungen
- 5.2 Elektronik
- 5.3 Landwirtschaft und Holzschutz
- 5.4 Medizin
- 5.5 Andere Verwendungen
- 6 Wo ist?
- 7 Wie kommst du??
- 8 Referenzen
Geschichte seiner Entdeckung
Der Name "Arsen" stammt aus dem lateinischen Arsenicum und dem griechischen Arsenikon und bezieht sich auf das gelbe Orpiment, das die Hauptform der Verwendung von Arsen durch Alchemisten war.
Arsen war lange bevor es als chemisches Element erkannt wurde, bekannt und wurde in Form seiner Verbindungen verwendet. Zum Beispiel Aristoteles im 4. Jahrhundert vor Christus. schrieb über Sandarache, eine Substanz, von der jetzt angenommen wird, dass sie Arsen-Sulfid ist.
Plinius der Ältere und Pedanius Discórides beschrieben im 1. Jahrhundert n. Chr. Orpiment, ein Mineral aus AszweiS.3. Im 11. Jahrhundert wurden drei Arten von Arsen erkannt: Weiß (As4ODER4), das Gelb (AszweiS.3) und rot (As4S.4).
Arsen als reines Element wurde erstmals von Albertus Magnus (1250) beobachtet. Magnus erhitzte das Arsensulfid mit Seife und bemerkte das Auftreten einer Substanz mit einer Eigenschaft, die dem grauen Allotrop im Bild ähnlich ist. Der erste authentische Bericht über seine Isolation wurde jedoch 1649 von Johann Schroeder, einem deutschen Apotheker, veröffentlicht..
Schröder stellte das Arsen durch Erhitzen seines Oxids mit Holzkohle her. Anschließend gelang es Nicolas Lémery, es durch Erhitzen einer Mischung aus Arsenoxid, Seife und Kali herzustellen. Im 18. Jahrhundert wurde dieses Element schließlich als Halbmetall anerkannt.
Struktur von Arsen
Arsen ist isomorph zu Antimon; das heißt, sie sind strukturell identisch und unterscheiden sich nur in der Größe ihrer Atome. Jedes Arsenatom bildet drei kovalente Bindungen As-As, so dass sie hexagonale Einheiten As bilden6 "Faltig oder steil", da die Hybridisierung der As-Atome sp3.
Dann werden die Einheiten As6 Sie verbinden sich und bilden schiere Arsenschichten, die schwach miteinander interagieren. Rhomboedrische graue Arsenkristalle verleihen dem Feststoff aufgrund ihrer intermolekularen Kräfte, die vor allem von ihren Atommassen abhängen, eine zerbrechliche und spröde Textur..
Möglicherweise aufgrund der Abstoßung des freien Elektronenpaars Arsen ist das As6 zwischen parallelen Schichten gebildet definieren kein perfektes, aber verzerrtes Oktaeder:
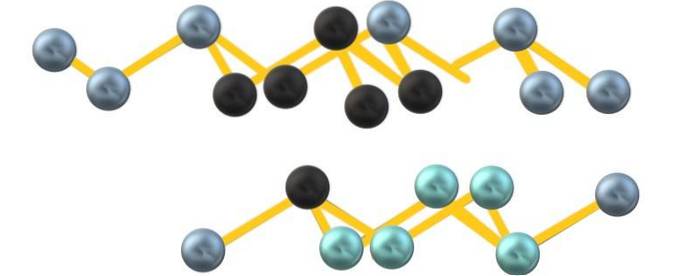
Beachten Sie, dass die schwarzen Kugeln die verzerrte Ebene im Raum zwischen zwei steilen Schichten zeichnen. Ebenso befinden sich in der darunter liegenden Schicht bläuliche Kugeln, die zusammen mit der schwarzen Kugel die Einheit As bilden6 am Anfang des Abschnitts erwähnt.
Die Struktur sieht ordentlich aus, die Reihen gehen auf und ab und sind daher kristallin. Es kann jedoch amorph werden, wobei die Kugeln auf unterschiedliche Weise zusammengedrückt werden. Wenn graues Arsen amorph wird, wandelt es sich in einen Halbleiter um.
Gelbes Arsen
Gelbes Arsen, das giftigste Allotrop dieses Elements, ist ein rein molekularer Feststoff. Es besteht aus Molekülen von As4 Einheiten durch schwache Ausbreitungskräfte, die nicht verhindern, dass sie sich verflüchtigen.
Schwarzes Arsen
Schwarzes Arsen ist amorph; aber nicht wie das graue Allotrop sein kann. Seine Struktur ist der gerade beschriebenen etwas ähnlich, mit dem Unterschied, dass seine Ebenen von Einheiten As6 haben größere Flächen und unterschiedliche Muster der Unordnung.
Elektronische Konfiguration
[Ar] 3d104szwei4p3
Es sind alle Orbitale der Stufe 3 gefüllt. Bildet Bindungen unter Verwendung der 4s- und 4p-Orbitale (genau wie die 4d) durch verschiedene chemische Hybridisierungen.
Eigenschaften
Molekulargewicht
74,922 g / mol
Physische Beschreibung
Graues Arsen ist ein grauer Feststoff mit einem metallischen Aussehen und einer spröden Konsistenz..
Farbe
Drei allotrope Formen, gelb (alpha), schwarz (beta) und grau (gamma).
Geruch
Toilette
Geschmack
Geschmacklos
Schmelzpunkt
1.090 K bei 35,8 atm (Tripelpunkt Arsen).
Bei normalem Druck hat es keinen Schmelzpunkt, da es auf 887 K sublimiert.
Dichte
-Graues Arsen: 5,73 g / cm3.
-Gelbes Arsen: 1,97 g / cm3.
Wasserlöslichkeit
Unlöslich
Atomradio
139 Uhr
Atomvolumen
13,1 cm3/ mol
Kovalenter Radius
120 Uhr
Spezifische Wärme
0,328 J / gmol bei 20 ° C.
Verdunstungswärme
32,4 kJ / mol
Elektronegativität
2.18 auf der Pauling-Skala
Ionisationsenergie
Erste Ionisierungsenergie 946,2 kJ / mol
Oxidationszustände
-3, +3, +5
Stabilität
Elementares Arsen ist in trockener Luft stabil, aber wenn es feuchter Luft ausgesetzt wird, wird es mit einer bronzegelben Schicht bedeckt, die zu einer schwarzen Schicht aus Arsenoxid (As) werden kannzweiODER3).
Zersetzung
Wenn Arsen zur Zersetzung erhitzt wird, gibt es weißen Rauch von As abzweiODER3. Das Verfahren ist gefährlich, da auch Arsin, ein sehr giftiges Gas, freigesetzt werden kann.
Selbstentzündung
180 ºC
Härte
3,5 auf der Mohsschen Härteskala.
Reaktivität
Es wird nicht von kalter Schwefelsäure oder konzentrierter Salzsäure angegriffen. Reagiert mit heißer Salpetersäure oder Schwefelsäure unter Bildung von Arsen und Arsen.
Wenn graues Arsen durch Erhitzen verflüchtigt wird und die Dämpfe schnell abgekühlt werden, entsteht ein gelbes Arsen. Dies kehrt zur grauen Form zurück, wenn es ultraviolettem Licht ausgesetzt wird.
Anwendungen
Legierungen
Eine kleine Menge Arsen, die dem Blei zugesetzt wird, härtet seine Legierungen so weit aus, dass sie bei der Beschichtung von Kabeln und bei der Herstellung von Autobatterien verwendet werden können..
Die Zugabe von Arsen zu Messing, einer Legierung aus Kupfer und Zink, erhöht die Korrosionsbeständigkeit. Andererseits korrigiert oder verringert es den Zinkverlust im Messing, was zu einer Verlängerung seiner Lebensdauer führt..
Elektronik
Gereinigtes Arsen wird in der Halbleitertechnologie verwendet, wo es in Verbindung mit Gallium und Germanium verwendet wird, sowie in Form von Galliumarsenid (GaAs), dem zweithäufigsten Halbleiter.
GaAs haben eine direkte Bandlücke, die bei der Herstellung von Dioden, Lasern und LEDs verwendet werden kann. Neben Galliumarsenid gibt es noch andere Arsenide wie Indiumarsenid und Aluminiumarsenid, die ebenfalls III-V-Halbleiter sind..
Inzwischen ist Cadmiumarsenid ein Halbleiter vom Typ II-IV. Arsin wurde bei der Halbleiterdotierung verwendet.
Landwirtschaft und Holzschutz
Die meisten Anwendungen wurden aufgrund ihrer hohen Toxizität und der ihrer Verbindungen verschrottet. Das AsszweiODER3 wurde als Pestizid verwendet, während AszweiODER5 ist ein Bestandteil von Herbiziden und Insektiziden.
Arsen (H)3AsO4) und Salze wie Calciumarsenat und Bleiarsenat wurden verwendet, um Böden zu sterilisieren und Schädlinge zu bekämpfen. Dies birgt das Risiko einer Kontamination der Umwelt mit Arsen..
Bleiarsenat wurde bis zur ersten Hälfte des 20. Jahrhunderts als Insektizid bei Obstbäumen eingesetzt. Aufgrund seiner Toxizität wurde es jedoch durch Natriummethylarsenat ersetzt, das seit 2013 aus demselben Grund nicht mehr verwendet wird.
Medizinisch
Bis zum 20. Jahrhundert wurden mehrere seiner Verbindungen als Arzneimittel verwendet. Arsphenamin und Neolsalvarsan wurden zum Beispiel bei der Behandlung von Syphilis und Trypanosomiasis verwendet.
Im Jahr 2000 wurde die Verwendung von AszweiODER3, Sehr toxische Verbindung bei der Behandlung von akuter Promyelozyten-Leukämie, die gegen all-trans-Retinsäure resistent ist. Kürzlich wurde das radioaktive Isotop verwendet 74Ass zur Tumorlokalisierung.
Das Isotop erzeugt gute Bilder, die klarer sind als die mit dem 124Ich, weil Jod zur Schilddrüse transportiert wird und Rauschen im Signal erzeugt.
Andere Verwendungen
Arsen wurde in der Vergangenheit als Futtermittelzusatzstoff bei der Geflügel- und Schweineproduktion verwendet.
Es wird als Katalysator bei der Herstellung von Ethylenoxid verwendet. Es wird auch in Feuerwerkskörpern und zum Bräunen verwendet. Arsenoxid wird als Entfärbungsmittel bei der Herstellung von Glas verwendet.
Wo befindet es sich??
Arsen kann in geringen Mengen im elementaren Zustand mit einem hohen Reinheitsgrad gefunden werden. Es ist in zahlreichen Verbindungen vorhanden, wie z. B.: Sulfiden, Arseniden und Sulfoarseniiden.
Es kommt auch in verschiedenen Mineralien vor, darunter: Arsenopyrit (FeSAs), Loellingit (FeAs)zwei), Enargit (Cu3Arsch4), das Orpiment (AszweiS.3) und Realgar (As4S.4).
Wie wird es erhalten?
Arsenopyrit wird in Abwesenheit von Luft auf 650-700ºC erhitzt. Das Arsen verdampft und hinterlässt Eisensulfid (FeS) als Rückstand. Während dieses Prozesses verbindet Arsen Sauerstoff mit As4ODER6, bekannt als "weißes Arsen".
Das Ass4ODER6 wird geändert, um das As zu bildenzweiODER3, deren Dämpfe in einer Reihe von Ziegelkammern gesammelt und kondensiert werden, wobei das Arsen durch Sublimation gereinigt wird.
Der größte Teil des Arsen wird durch Reduktion des aus As gebildeten Staubes durch Kohlenstoff erzeugtzweiODER3.
Verweise
- Stephen R. Marsden. (23. April 2019). Chemie des Arsen. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (3. Dezember 2018). Interessante Fakten über Arsen. Wiederhergestellt von :oughtco.com
- Wikipedia. (2019). Arsen. Wiederhergestellt von: en.wikipedia.org
- Dr. Dough Stewart. (2019). Fakten zu Arsenelementen. Chemicool. Wiederhergestellt von: chemicool.com
- Royal Society of Chemistry. (2019). Arsen. Wiederhergestellt von: rsc.or
- Die Herausgeber der Encyclopaedia Britannica. (03. Mai 2019). Arsen. Encyclopædia Britannica. Wiederhergestellt von: britannica.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.