
Anisolstruktur, Eigenschaften, Nomenklatur, Risiken und Verwendungen
Das Anisol oder Methoxybenzol ist eine organische Verbindung, die aus einem aromatischen Ether besteht, dessen chemische Formel C ist6H.5OCH3. Sein physikalischer Zustand ist der einer farblosen Flüssigkeit, die gelbliche Färbungen aufweisen kann. Es ist leicht an seinem charakteristischen Anisgeruch zu erkennen.
Es ist dann eine flüchtige Verbindung und nicht sehr hohe Kohäsionskräfte; typische Eigenschaften von Leichtethern, die in kleinen verschlossenen Behältern gelagert werden. Insbesondere ist Anisol der einfachste der Alkylarylether; das heißt, diejenigen mit einer aromatischen Komponente (Ar) und einer anderen Alkylkomponente (R), Ar-O-R.
Gruppe C.6H.5- kommt, um Ar und -CH zu bezeichnen3 zu R, also mit C.6H.5-O-CH3. Der aromatische Ring und die Anwesenheit von -OCH3 Als Substituentengruppe namens Methoxy verleiht es Anisol eine Nucleophilie, die der von Benzol und Nitrobenzol überlegen ist. Daher dient es als Zwischenmolekül für die Synthese von Verbindungen mit pharmakologischer Aktivität..
Sein charakteristischer Anisgeruch wurde verwendet, um Kosmetik- und Hygieneprodukten, die einen angenehmen Duft erfordern, Anisol zu verleihen..
Artikelverzeichnis
- 1 Struktur von Anisol
- 1.1 Dipolmoment
- 1.2 Kristalle
- 2 Eigenschaften
- 2.1 Aussehen
- 2.2 Geruch
- 2.3 Geschmack
- 2.4 Molekularmasse
- 2.5 Dichte
- 2.6 Dampfdichte
- 2.7 Schmelzpunkt
- 2.8 Siedepunkt
- 2.9 Flammpunkt
- 2.10 Selbstentzündungstemperatur
- 2.11 Viskosität
- 2.12 Oberflächenspannung
- 2.13 Brechungsindex
- 2.14 Löslichkeit
- 2,15 Nucleophilie
- 2.16 Reaktivität
- 3 Nomenklatur
- 4 Risiken
- 5 Verwendungen
- 5.1 Organische Synthesen
- 5.2 Düfte
- 6 Referenzen
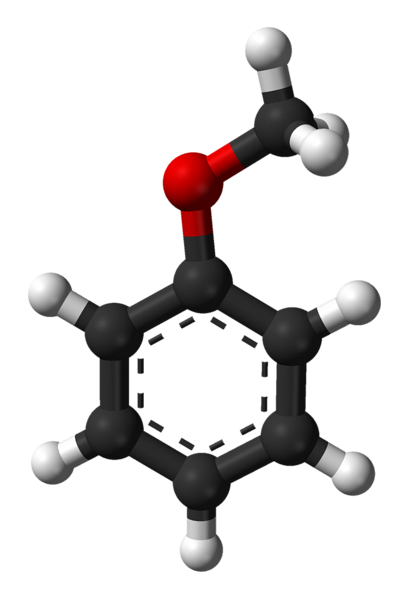
Anisolstruktur
Das obere Bild zeigt die molekulare Struktur von Anisol anhand eines Kugel- und Balkenmodells. Der aromatische Ring wird geschätzt, dessen Kohlenstoffe spzwei und deshalb ist es flach wie ein sechseckiges Blatt; und daran gebunden ist die Methoxygruppe, deren Kohlenstoff sp3, und seine Wasserstoffatome befinden sich oberhalb oder unterhalb der Ringebene.
Die Bedeutung der -OCH-Gruppe3 in der Struktur geht es über das Brechen mit der ebenen Geometrie des Moleküls hinaus: Es verleiht ihm Polarität, und folglich erhält das unpolare Molekül von Benzol ein permanentes Dipolmoment.
Dipolmoment
Dieses Dipolmoment ist auf das Sauerstoffatom zurückzuführen, das die Elektronendichten sowohl des aromatischen als auch des Methylrings anzieht. Dank dessen können Anisolmoleküle durch Dipol-Dipol-Kräfte interagieren. Obwohl es keine Möglichkeit zur Bildung von Wasserstoffbrückenbindungen gibt, da es sich um einen Ether handelt (bei ROR ist H nicht an Sauerstoff gebunden)..
Sein hoher Siedepunkt (154 ° C) bestätigt experimentell die starken intermolekularen Wechselwirkungen, die seine Flüssigkeit steuern. Ebenso sind die Londoner Dispersionskräfte vorhanden, abhängig von der Molekülmasse und den π-π-Wechselwirkungen zwischen den Ringen selbst.
Kristalle
Die Struktur von Anisol erlaubt es jedoch nicht, stark genug zu interagieren, um bei Raumtemperatur einen Feststoff anzunehmen (Fp = -37ºC). Dies kann auch auf die Tatsache zurückzuführen sein, dass bei Verringerung der intermolekularen Abstände die elektrostatischen Abstoßungen zwischen den Elektronen benachbarter aromatischer Ringe stark an Kraft gewinnen..
Daher können laut kristallographischen Untersuchungen die Anisolmoleküle in Kristallen bei einer Temperatur von -173ºC nicht so angeordnet werden, dass ihre Ringe einander zugewandt sind; das heißt, ihre aromatischen Zentren sind nicht übereinander ausgerichtet, sondern eine Gruppe -OCH3 befindet sich über oder unter einem benachbarten Ring.
Eigenschaften
Aussehen
Farblose Flüssigkeit, aber das kann leichte strohfarbene Töne haben.
Geruch
Riecht leicht nach Anissamen.
Geschmack
Süßigkeiten; Da es jedoch mäßig giftig ist, ist dieser Test gefährlich.
Molekulare Masse
108,140 g / mol.
Dichte
0,995 g / ml.
Wasserdampfdichte
3,72 (relativ zu Luft = 1).
Schmelzpunkt
-37ºC.
Siedepunkt
154ºC.
Zündpunkt
125ºC (offene Tasse).
Selbstentzündungstemperatur
475ºC.
Viskosität
0,778 cP bei 30 ° C..
Oberflächenspannung
34,15 Dyn / cm bei 30ºC.
Brechungsindikator
1,5179 bei 20ºC.
Löslichkeit
In Wasser schlecht löslich (ca. 1 mg / ml). In anderen Lösungsmitteln wie Aceton, Ethern und Alkoholen ist es jedoch sehr löslich.
Nucleophilie
Der aromatische Ring des Anisols ist reich an Elektronen. Dies liegt daran, dass Sauerstoff, obwohl er ein hoch elektronegatives Atom ist, mit den Elektronen aus seiner π-Wolke dazu beiträgt, sie in zahlreichen Resonanzstrukturen durch den Ring zu delokalisieren. Folglich wandern mehr Elektronen durch das aromatische System und daher nimmt seine Nucleophilie zu..
Die Zunahme der Nucleophilie wurde experimentell gezeigt, indem ihre Reaktivität gegenüber aromatischen elektrophilen Substitutionen mit der von Benzol verglichen wurde. Somit wird der bemerkenswerte Effekt der -OCH-Gruppe nachgewiesen.3 auf die chemischen Eigenschaften der Verbindung.
Ebenso ist anzumerken, dass die elektrophilen Substitutionen an den Positionen neben (-orto) und gegenüber (-para) der Methoxygruppe auftreten; das heißt, es ist ortho-para Direktor.
Reaktivität
Die Nucleophilie des aromatischen Anisolrings erlaubt bereits einen Einblick in seine Reaktivität. Die Substitutionen können entweder im Ring (begünstigt durch seine Nucleophilie) oder in der Methoxygruppe selbst auftreten; in letzterem ist die O-CH-Bindung gebrochen3 -CH zu ersetzen3 durch eine andere Alkylgruppe: O-Alkylierung.
Daher kann das Anisol in einem Alkylierungsprozess eine R-Gruppe (Fragment eines anderen Moleküls) akzeptieren, indem es ein H an seinem Ring substituiert (C-Alkylierung) oder indem es das CH substituiert3 seiner Methoxygruppe. Das folgende Bild zeigt, was gerade gesagt wurde:
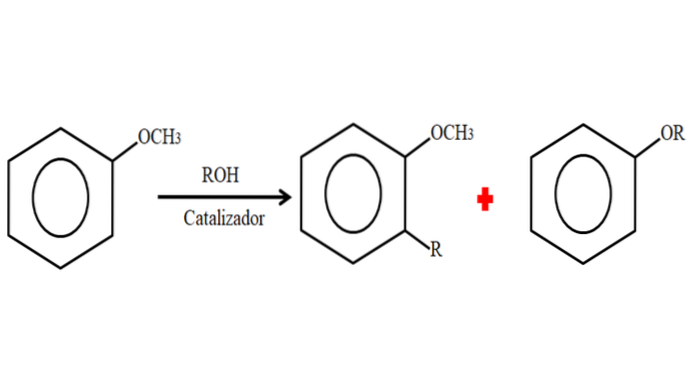
Im Bild befindet sich die R-Gruppe in der Position -orto, kann sich aber auch in der Position -para gegenüber der -OCH-Position befinden3. Wenn eine O-Alkylierung stattfindet, wird ein neuer Ether mit einer anderen -OR-Gruppe erhalten.
Nomenklatur
Der Name "Anisol" ist der bekannteste und am meisten akzeptierte, der höchstwahrscheinlich von seinem anisartigen Geruch herrührt. Der Name "Methoxybenzol" ist jedoch ziemlich spezifisch, da er sofort die Struktur und Identität dieses aromatischen Ethers festlegt; Dies ist der Name, der von der systematischen Nomenklatur bestimmt wird.
Ein anderer weniger gebräuchlicher, aber ebenso gültiger Name ist "Phenylmethylether", der der traditionellen Nomenklatur unterliegt. Dies ist vielleicht der spezifischste Name von allen, da er direkt angibt, welche der beiden strukturellen Teile des Ethers sind: Phenyl-O-methyl, C.6H.5-O-CH3.
Risiken
Medizinische Studien konnten die möglichen tödlichen Auswirkungen von Anisol im Körper bei niedrigen Dosen noch nicht nachweisen. Wie fast alle Chemikalien verursacht es jedoch Reizungen, wenn es zu lange und in mäßigen Konzentrationen Haut, Rachen, Lunge und Augen ausgesetzt wird..
Aufgrund der Nucleophilie seines Rings wird ein Teil davon metabolisiert und ist daher biologisch abbaubar. Aufgrund dieser Eigenschaft zeigten Simulationen, dass es sich nicht in wässrigen Ökosystemen konzentrieren kann, da seine Organismen es zum ersten Mal abbauen. und deshalb können Flüsse, Seen oder Meere Anisol ansammeln.
In Böden verdunstet es aufgrund seiner Flüchtigkeit schnell und wird von Luftströmungen weggetragen; Dies hat auch keinen wesentlichen Einfluss auf die Pflanzenmassen oder Plantagen.
Andererseits reagiert es atmosphärisch mit freien Radikalen und stellt daher kein Kontaminationsrisiko für die Luft dar, die wir atmen..
Anwendungen
Organische Synthesen
Aus Anisol können andere Derivate durch aromatische elektrophile Substitution erhalten werden. Dies ermöglicht die Verwendung als Zwischenprodukt für die Synthese von Arzneimitteln, Pestiziden und Lösungsmitteln, zu denen seine Eigenschaften hinzugefügt werden sollen. Synthesewege können hauptsächlich aus C-Alkylierung oder O-Alkylierung bestehen.
Düfte
Zusätzlich zu seiner Verwendung für die organische Synthese kann es direkt als Additiv für Cremes, Salben und Parfums verwendet werden, wobei Anis-Duftstoffe in solche Produkte eingearbeitet werden..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. A. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Anisol. PubChem-Datenbank, CID = 7519. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisol. Wiederhergestellt von: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C. und Lachter, Elizabeth R. (2010). Flüssigphasenalkylierung von Anisol und Phenol, katalysiert durch Niobphosphat. Journal of the Brazilian Chemical Society, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. und Goddard R. (2015). Anisol bei 100 K: die erste Kristallstrukturbestimmung. Acta Crystallogr C Struct Chem. Aug; 71 (Pt 8): 664 & ndash; 6. doi: 10.1107 / S2053229615012553
- Chemische Formulierung. (2018). Methoxybenzol Wiederhergestellt von: formulacionquimica.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.