
Struktur, Eigenschaften, Nomenklatur und Verwendung der Alkohole
Das Alkohole es handelt sich um organische Verbindungen, die dadurch gekennzeichnet sind, dass eine Hydroxylgruppe (-OH) an einen gesättigten Kohlenstoff gebunden ist; das heißt, ein Kohlenstoff, der durch Einfachbindungen (ohne Doppel- oder Dreifachbindungen) an vier Atome gebunden ist).
Die generische Formel für diese große und vielseitige Familie von Verbindungen lautet ROH. Um als Alkohol im rein chemischen Sinne zu gelten, muss die OH-Gruppe in der Molekülstruktur am reaktivsten sein. Dies ist wichtig, um unter mehreren Molekülen mit OH-Gruppen bestätigen zu können, welches von ihnen ein Alkohol ist..

Einer der wichtigsten Alkohole und der bekannteste in der Populärkultur ist Ethylalkohol oder Ethanol, CH3CHzweiOH. Abhängig von ihrer natürlichen Herkunft und damit ihrer chemischen Umgebung können ihre Mischungen ein unbegrenztes Spektrum an Aromen hervorbringen. Einige zeigen sogar positive Veränderungen am Gaumen mit der Fliege der Jahre.
Sie sind die Gemische von organischen und anorganischen Verbindungen mit Ethylalkohol, die seit Zeiten vor Christus zu ihrem Konsum bei sozialen und religiösen Ereignissen führen. wie mit Traubenwein oder mit Gläsern, die zu einer Feier serviert werden, zusätzlich zu Schlägen, Süßigkeiten, Panettones usw..
Der Genuss dieser Getränke in Maßen ist das Ergebnis der Synergie zwischen Ethylalkohol und seiner einhüllenden chemischen Matrix; ohne es wird es als reine Substanz extrem gefährlich und löst eine Reihe negativer gesundheitlicher Folgen aus.
Aus diesem Grund ist der Verbrauch von wässrigen Gemischen von CH3CHzweiOH stellt wie die in Apotheken zu antiseptischen Zwecken gekauften ein großes Risiko für den Körper dar.
Andere Alkohole, die ebenfalls sehr beliebt sind, sind Menthol und Glycerin. Letzteres sowie Erythrol sind in vielen Lebensmitteln als Zusatz enthalten, um sie während der Lagerung zu süßen und zu konservieren. Es gibt Regierungsstellen, die vorschreiben, welche Alkohole ohne Sicherheitseffekte verwendet oder konsumiert werden dürfen..
Nach dem täglichen Gebrauch von Alkoholen sind sie chemisch sehr vielseitige Substanzen, da ausgehend von ihnen andere organische Verbindungen synthetisiert werden können; bis zu dem Punkt, dass einige Autoren glauben, dass mit einem Dutzend von ihnen alle notwendigen Verbindungen geschaffen werden können, um auf einer einsamen Insel zu leben.
Artikelverzeichnis
- 1 Struktur von Alkoholen
- 1.1 Amphiphiler Charakter
- 1.2 Struktur von R.
- 2 Physikalische und chemische Eigenschaften
- 2.1 Siedepunkt
- 2.2 Lösungsmittelkapazität
- 2.3 Amphoterismus
- 3 Nomenklatur
- 3.1 Allgemeiner Name
- 3.2 IUPAC-System
- 4 Synthese
- 4.1 Hydratisierung von Alkenen
- 4.2 Oxo-Prozess
- 4.3 Fermentation von Kohlenhydraten
- 5 Verwendungen
- 5.1 Getränke
- 5.2 Chemischer Rohstoff
- 5.3 Lösungsmittel
- 5.4 Kraftstoffe
- 5.5 Antiseptika
- 5.6 Andere Verwendungen
- 6 Referenzen
Struktur von Alkoholen
Alkohole haben eine allgemeine Formel von ROH. Die OH-Gruppe ist an die Alkylgruppe R gebunden, deren Struktur von Alkohol zu Alkohol unterschiedlich ist. Die Vereinigung zwischen R und OH erfolgt über eine einfache kovalente Bindung, R-OH.
Das folgende Bild zeigt drei generische Strukturen für Alkohole, wobei zu berücksichtigen ist, dass das Kohlenstoffatom gesättigt ist. Das heißt, es bildet vier einfache Links.
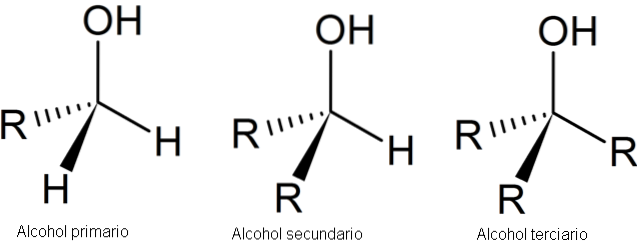
Wie zu sehen ist, kann R ein beliebiges Kohlenstoffgerüst sein, solange es keine reaktiveren Substituenten als die OH-Gruppe aufweist..
Für den Fall des primären Alkohols 1. ist die OH-Gruppe an einen primären Kohlenstoff gebunden. Dies lässt sich leicht überprüfen, indem beobachtet wird, dass das Atom in der Mitte des linken Tetraeders an ein R und zwei H gebunden ist.
Der sekundäre Alkohol 2º wird mit dem Kohlenstoff des Tetraeders im Zentrum verifiziert, der nun mit zwei R-Gruppen und einem H verbunden ist.
Und schließlich gibt es den tertiären Alkohol 3º, dessen Kohlenstoff an drei R-Gruppen gebunden ist.
Amphiphiler Charakter
Abhängig von der Art des an das OH gebundenen Kohlenstoffs gibt es die Klassifizierung von primären, sekundären und tertiären Alkoholen. In den Tetraedern wurden die strukturellen Unterschiede zwischen ihnen bereits detailliert beschrieben. Alle Alkohole, unabhängig von ihrer Struktur, haben jedoch etwas gemeinsam: den amphiphilen Charakter..
Sie müssen eine Struktur nicht ansprechen, um sie zu bemerken, sondern nur ihre chemische ROH-Formel. Die Alkylgruppe besteht fast ausschließlich aus Kohlenstoffatomen, die ein hydrophobes Grundgerüst "zusammensetzen"; das heißt, es interagiert sehr schwach mit Wasser.
Andererseits kann die OH-Gruppe Wasserstoffbrücken mit Wassermolekülen bilden und somit hydrophil sein; das heißt, liebt oder hat eine Affinität zu Wasser. Alkohole haben also ein hydrophobes Rückgrat, das an eine hydrophile Gruppe gebunden ist. Sie sind gleichzeitig unpolar und polar, was bedeutet, dass es sich um amphiphile Substanzen handelt.
R-OH
(Hydrophob) - (Hydrophil)
Wie im nächsten Abschnitt erläutert wird, definiert der amphiphile Charakter von Alkoholen einige ihrer chemischen Eigenschaften..
Struktur von R.
Die Alkylgruppe R kann jede Struktur haben, und dennoch ist es wichtig, dass damit Alkohole katalogisiert werden können.
Beispielsweise kann R eine offene Kette sein, wie dies bei Ethanol oder Propanol der Fall ist; verzweigt wie t-Butylalkohol (CH3)zweiCHCHzweiOH; es kann zyklisch sein, wie im Fall von Cyclohexanol; oder es kann einen aromatischen Ring haben, wie in Benzylalkohol (C.6H.5) CHzweiOH oder in 3-Phenylpropanol (C.6H.5) CHzweiCHzweiCHzweiOh.
Die R-Kette kann sogar Substituenten wie Halogene oder Doppelbindungen aufweisen, beispielsweise für die Alkohole 2-Chlorethanol und 2-Buten-1-ol (CH)3CHzwei= CHCHzweiOH).
Unter Berücksichtigung der Struktur von R wird die Klassifizierung von Alkoholen komplex. Aus diesem Grund ist die Klassifizierung anhand ihrer Struktur (1., 2. und 3. Alkohol) einfacher, aber weniger spezifisch, obwohl es ausreicht, die Reaktivität von Alkoholen zu erklären..
Physikalische und chemische Eigenschaften
Siedepunkt
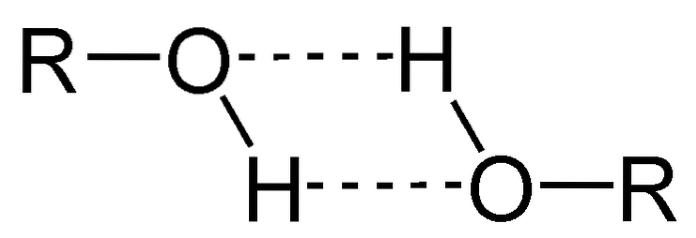
Eine der Haupteigenschaften von Alkoholen ist, dass sie sich über Wasserstoffbrücken verbinden.
Im Bild oben sehen Sie, wie zwei ROH-Moleküle Wasserstoffbrückenbindungen miteinander eingehen. Dank dessen sind Alkohole normalerweise Flüssigkeiten mit hohen Siedepunkten..
Beispielsweise hat Ethylalkohol einen Siedepunkt von 78,5 ° C. Dieser Wert steigt an, wenn der Alkohol schwerer wird. das heißt, die R-Gruppe hat eine größere Masse oder Anzahl von Atomen. Somit ist n-Butylalkohol, CH3CHzweiCHzweiCHzweiOH hat einen Siedepunkt von 97ºC, etwas niedriger als der von Wasser.
Glycerin ist einer der Alkohole mit dem höchsten Siedepunkt: 290 ° C..
Warum? Denn nicht nur die Masse oder Struktur von R beeinflusst, sondern auch die Anzahl der OH-Gruppen. Glycerin hat drei OHs in seiner Struktur: (HO) CHzweiCH (OH) CHzwei(OH). Dies macht es in der Lage, viele Wasserstoffbrückenbindungen zu bilden und seine Moleküle enger zusammenzuhalten..
Andererseits, Einige Alkohole sind fest bei Raumtemperatur; als das gleiche Glycerin bei einer Temperatur unter 18ºC. Daher ist die Aussage, dass alle Alkohole flüssige Substanzen sind, falsch..
Lösungsmittelkapazität
In Privathaushalten wird häufig auf Isopropylalkohol zurückgegriffen, um Flecken zu entfernen, die auf einer Oberfläche nur schwer zu entfernen sind. Diese Lösungsmittelkapazität, die für die chemische Synthese sehr nützlich ist, beruht auf ihrem zuvor erläuterten amphiphilen Charakter.
Fette zeichnen sich durch Hydrophobie aus: Deshalb ist es schwierig, sie mit Wasser zu entfernen. Im Gegensatz zu Wasser haben Alkohole jedoch einen hydrophoben Anteil an ihrer Struktur.
Somit interagiert seine Alkylgruppe R mit Fetten, während die OH-Gruppe mit Wasser Wasserstoffbrückenbindungen bildet, die dazu beitragen, diese zu verdrängen..
Amphoterismus
Alkohole können als Säuren und Basen reagieren; das heißt, sie sind amphotere Substanzen. Dies wird durch die folgenden zwei chemischen Gleichungen dargestellt:
ROH + H.+ => ROHzwei+
ROH + OH- => RO-
RO- ist die allgemeine Formel eines sogenannten Alkoxids.
Nomenklatur
Es gibt zwei Möglichkeiten, Alkohole zu benennen, deren Komplexität von ihrer Struktur abhängt.
Gemeinsamen Namen
Alkohole können mit ihren gebräuchlichen Namen bezeichnet werden. Welche sind? Dazu muss der Name der R-Gruppe bekannt sein, zu der die Endung -ico hinzugefügt wird und dem das Wort 'Alkohol' vorangestellt ist. Zum Beispiel der CH3CHzweiCHzweiOH ist Propylalkohol.
Andere Beispiele sind:
-CH3OH: Methylalkohol
-(CH3)zweiCHCHzweiOH: Isobutylalkohol
-(CH3)3COH: tert-Butylalkohol
IUPAC-System
Bei gebräuchlichen Namen müssen Sie zunächst R identifizieren. Der Vorteil dieses Systems besteht darin, dass es viel genauer ist als das andere..
R, das ein Kohlenstoffgerüst ist, kann Zweige oder mehrere Ketten haben; Die längste Kette, dh mit mehr Kohlenstoffatomen, erhält den Namen Alkohol.
Zum Namen des Alkans der längsten Kette wird die Endung 'l' hinzugefügt. Deshalb bei CH3CHzweiOH heißt Ethanol (CH3CHzwei- + OH).
Im Allgemeinen sollte das OH die niedrigstmögliche Aufzählung haben. Zum Beispiel der BrCHzweiCHzweiCHzwei(OH) CH3 wird 4-Brom-2-butanol und nicht 1-Brom-3-butanol genannt.
Synthese
Alkenhydratation
Der Ölcrackprozess erzeugt eine Mischung von Alkenen mit vier oder fünf Kohlenstoffatomen, die leicht getrennt werden können.
Diese Alkene können durch direkte Zugabe von Wasser oder durch Reaktion des Alkens mit Schwefelsäure in Alkohole umgewandelt werden, gefolgt von der Zugabe des Wassers, das die Säure spaltet und den Alkohol erzeugt..
Oxo-Prozess
In Gegenwart eines geeigneten Katalysators reagieren Alkene mit Kohlenmonoxid und Wasserstoff unter Bildung von Aldehyden. Aldehyde können durch eine katalytische Hydrierungsreaktion leicht zu Alkoholen reduziert werden.
Oft kommt es zu einer solchen Synchronisation des Oxoprozesses, dass die Reduktion der Aldehyde nahezu zeitgleich mit ihrer Bildung erfolgt..
Der am häufigsten verwendete Katalysator ist Dicobaltoctocarbonyl, das durch die Reaktion zwischen Cobalt und Kohlenmonoxid erhalten wird.
Kohlenhydratfermentation
Die Fermentation von Kohlenhydraten durch Hefe ist bei der Herstellung von Ethanol und anderen Alkoholen nach wie vor von großer Bedeutung. Zucker stammen aus Zuckerrohr oder Stärke, die aus verschiedenen Körnern gewonnen werden. Aus diesem Grund wird Ethanol auch als "Getreidealkohol" bezeichnet.
Anwendungen
Getränke
Obwohl es nicht die Hauptfunktion von Alkoholen ist, ist das Vorhandensein von Ethanol in einigen Getränken eines der beliebtesten Erkenntnisse. So ist Ethanol, ein Produkt der Fermentation von Zuckerrohr, Trauben, Äpfeln usw., in zahlreichen Getränken für den sozialen Verbrauch enthalten.
Chemischer Rohstoff
-Methanol wird durch seine katalytische Oxidation zur Herstellung von Formaldehyd verwendet. Formaldehyd wird zur Herstellung von Kunststoffen, Farben, Textilien, Sprengstoffen usw. verwendet..
-Butanol wird zur Herstellung von Butanethanoat verwendet, einem Ester, der als Aroma in der Lebensmittel- und Süßwarenindustrie verwendet wird..
-Allylalkohol wird zur Herstellung von Estern verwendet, einschließlich Diallylphthalat und Diallylisophthalat, die als Monomere dienen.
-Phenol wird zur Herstellung von Harzen, zur Herstellung von Nylon, zu Deodorants, Kosmetika usw. verwendet..
-Alkohole mit einer geraden Kette von 11-16 Kohlenstoffatomen werden als Zwischenprodukte verwendet, um Weichmacher zu erhalten; zum Beispiel Polyvinylchlorid.
-Die sogenannten Fettalkohole werden als Zwischenprodukte bei der Synthese von Detergenzien verwendet.
Lösungsmittel
-Methanol wird als Farbverdünner verwendet, ebenso wie 1-Butanol und Isobutylalkohol.
-Ethylalkohol wird als Lösungsmittel für viele wasserunlösliche Verbindungen verwendet und als Lösungsmittel in Farben, Kosmetika usw. verwendet..
-Fettalkohole werden als Lösungsmittel in der Textilindustrie, in Farbstoffen, in Waschmitteln und in Farben verwendet. Isobutanol wird als Lösungsmittel in Beschichtungsmaterialien, Farben und Klebstoffen verwendet.
Kraftstoffe
-Methanol wird als Kraftstoff in Verbrennungsmotoren und als Benzinzusatz zur Verbesserung der Verbrennung verwendet.
-Ethylalkohol wird in Kombination mit fossilen Brennstoffen in Kraftfahrzeugen verwendet. Zu diesem Zweck sind ausgedehnte Regionen Brasiliens für den Anbau von Zuckerrohr zur Herstellung von Ethylalkohol bestimmt. Dieser Alkohol hat den Vorteil, dass bei seiner Verbrennung nur Kohlendioxid entsteht..
Wenn Ethylalkohol verbrannt wird, entsteht eine saubere, rauchfreie Flamme, weshalb er in Feldküchen als Brennstoff verwendet wird..
-Gelierter Alkohol wird durch Kombinieren von Methanol oder Ethanol mit Calciumacetat hergestellt. Dieser Alkohol wird als Wärmequelle in Feldöfen verwendet und ist sicherer als flüssige Alkohole, da er verschüttet wird.
-Das sogenannte Biobutanol wird als Kraftstoff beim Transport verwendet, ebenso Isopropylalkohol, der als Kraftstoff verwendet werden kann; obwohl seine Verwendung nicht empfohlen wird.
Antiseptika
Isopropylalkohol in einer Konzentration von 70% wird als äußeres Antiseptikum verwendet, um Keime zu entfernen und ihr Wachstum zu verzögern. Ebenso wird zu diesem Zweck Ethylalkohol verwendet..
Andere Verwendungen
Cyclohexanol und Methylcyclohexanol werden in der Textilveredelung, Möbelverarbeitung und Fleckenentfernung eingesetzt.
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Dr. JA Colapret. (s.f.). Alkohole. Wiederhergestellt von: colapret.cm.utexas.edu
- Die Bildungspartnerschaft für Alkoholpharmakologie. (s.f.). Was ist Alkohol? Duke University. Wiederhergestellt von: sites.duke.edu
- Whittemore F. (s.f.). Arten und Verwendungen von Alkohol. Wiederhergestellt von: livestrong.com
- Wikipedia. (2018). Alkohol. Wiederhergestellt von: en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.