
Nähragargrundierung, -zubereitung und -verwendung
Das Nährstoff-Agar Es ist ein festes nicht selektives und nicht differentielles Kulturmedium. In diesem Medium wachsen alle Arten von Bakterien, die aus ernährungsphysiologischer Sicht keine hohen Anforderungen stellen..
Es ist ein einfaches Medium und enthält trotz seines Namens einen niedrigeren Nährwert im Vergleich zu anderen ähnlichen Medien wie Brain Heart Infusion Agar oder Trypticase Soy Agar..
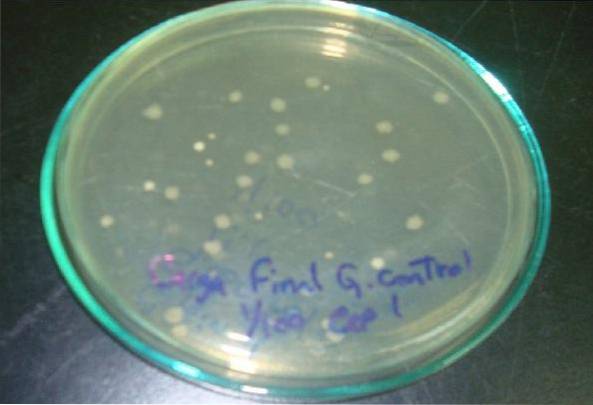
Seine Nützlichkeit im Labor ist sehr vielfältig. Wird hauptsächlich für die Subkultur von Arten, die Aufrechterhaltung von Stämmen und die Zählung von Kolonien verwendet, unter anderem als Grundlage für die Herstellung von Blutagar..
Ebenso wird aufgrund seiner hellbeigen Farbe die Produktion von Pigmenten erzeugt, die von einigen Bakterienstämmen erzeugt werden, wie z. B. dem grünlichen Pigment von Pseudomonas aeruginosa, das ziegelrote Pigment von Serratia marcescens bei Raumtemperatur das goldgelbe Pigment von Staphylococcus aureus, unter anderen.
Darüber hinaus ist es eines der billigsten Wachstumsmedien auf dem Markt..
Artikelverzeichnis
- 1 Begründung
- 2 Zusammensetzung
- 3 Vorbereitung
- 4 Verwendungen
- 4.1 Als Grundlage für die Herstellung von Blutagar
- 4.2 Stimulieren Sie die Sporulation sporenbildender Bakterien
- 4.3 Dehnungswartung
- 4.4 Anzahl der Kolonien
- 4.5 Diagnosetests ausführen
- 4.6 Rückgewinnung von mesophilen Aeroben aus Salzwasser (Strände)
- 5 Referenzen
Basis
Wie bereits oben erwähnt, handelt es sich um ein sehr einfaches Medium, das auf der Bereitstellung von Nährstoffen für das Bakterienwachstum ohne Einschränkung und ohne komplexe zu interpretierende Reaktionen basiert..
Da das Medium durchscheinend ist, ist es ideal zum Zählen von Kolonien nach der Tiefensaatmethode..
Komposition
Es besteht hauptsächlich aus Fleischextrakt oder Hefeextrakt, Peptonen oder Gelatine-Pankreas-Digest, Agar-Agar, Natriumchlorid und destilliertem Wasser..
Der Fleisch- oder Hefeextrakt und die Peptonen stellen die wesentlichen Kohlenstoff- und Mineralstoffquellen (Stickstoff, Phosphor und Schwefel) dar, die von Bakterien als Energie- und Wachstumsquelle genutzt werden..
Ebenso ist Agar-Agar die Basis aller festen Kulturmedien und ersetzt Gelatine, die die erste Basenverbindung war, die von Robert Koch verwendet wurde, um seinen Medien eine feste Konsistenz zu verleihen..
Agar ist ein Polysaccharid aus Galactose, Galactomannan, Agarose und Agaropektin. Setzt auf 40 ° C und schmilzt nahe 100 ° C..
Natriumchlorid seinerseits verleiht dem Medium die für die Bakterienentwicklung notwendige Osmolarität.
Schließlich dient das Wasser dazu, die lyophilisierten Verbindungen zu hydratisieren und aufzulösen. Es sollte destilliertes Wasser verwendet werden, das auf einen neutralen pH-Wert eingestellt ist. Leitungswasser sollte nicht verwendet werden, da es Kalzium und Magnesium enthält, die mit Phosphaten im Medium reagieren und unlösliche Salze bilden können..
Vorbereitung
Für einen Liter Nähragar müssen 31 g des dehydrierten Mediums gewogen werden. Es wird in einen Kolben gegeben und in einem Liter destilliertem Wasser gelöst. Nach 5 Minuten Stehenlassen über einer Wärmequelle erhitzen und konstant mischen, bis 1 oder 2 Minuten gekocht wird..

Der Kolben wird dann in einen Autoklaven gegeben und 20 Minuten bei 121ºC sterilisiert..

Am Ende der Zeit wird es aus dem Autoklaven entfernt und in sterilen Petrischalen unter Verwendung einer Laminar-Flow-Haube oder eines Bunsenbrenners serviert..
Wenn die Petrischalen wegwerfbar sind (Kunststoff), muss das Medium verteilt werden, wenn der Agar eine Temperatur von ungefähr 50 ° C hat, um zu verhindern, dass sie durch übermäßige Hitze verformt werden.
Erstarren lassen und auf einem umgedrehten Plattenhalter lagern und bis zur Verwendung bei 2-8 ° C kühlen.
Die Platten müssen vor dem Aussäen temperiert werden. Nähragarplatten sollten nicht verwendet werden, wenn sie kontaminiert oder dehydriert sind.
Der pH-Wert des hergestellten Mediums muss auf 7,3 ± 0,2 eingestellt werden.
Anwendungen
Es ist das einfachste Kulturmedium, das im mikrobiologischen Labor verwendet wird. Seine Formulierung eignet sich hervorragend für das Wachstum nicht anspruchsvoller Bakterien.
Die Hauptverwendungen werden nachfolgend erläutert:
Als Grundlage für die Herstellung von Blutagar
Dieses Medium wird manchmal als Base zur Herstellung von Blutagar verwendet, ist jedoch nicht die am häufigsten verwendete Base..
Stimulieren Sie die Sporulation sporenbildender Bakterien
Dieses Kulturmedium ist besonders nützlich zur Stimulierung der Sporulation von sporenbildenden Bakterien wie z Bacillus sp.
Dazu ein Stamm der Gattung Bazillus und 24 Stunden bei 37 ° C in Aerobiose inkubiert. Sobald die Kolonien gewachsen sind, wird die Platte einer Temperaturbelastung ausgesetzt, dh die Temperatur des Ofens wird auf 44 ° C erhöht und weitere 24 Stunden stehen gelassen oder 24 Stunden in einen Kühlschrank gestellt.
Am Ende der Zeit werden Abstriche der Kultur gemacht und mit Gram-Färbung oder mit Shaeffer-Fulton-Sporenfärbung gefärbt. In ihnen werden die Bazillen mit Endosporen (Sporen innerhalb des Bazillus) und Exosporen (Sporen außerhalb des Bazillus) beobachtet..
Dehnungswartung
Einige Forschungslabors oder universitäre Lehrunterstützungslabors verlangen, dass lebensfähige Bakterien von klinischer Bedeutung so lange wie möglich erhalten bleiben, um die Bakterienbank (bacterioteca) für Forschungsarbeiten oder zur Vorbereitung von Unterrichtspraktiken zu verwenden, in denen die Schüler lernen, zu manipulieren und zu manipulieren identifizieren diese Mikroorganismen.
Zu diesem Zweck können sowohl Nähragar als auch Hirnherzinfusionsagar verwendet werden. Der Agar wird hergestellt, in Röhrchen mit einem Bakelitdeckel gegossen und auf einen Boden gekippt, so dass sich der Agar verfestigt und einen Block am Boden und eine Abschrägung auf der Oberfläche bildet (Flötenschnabel)..
Jedes Röhrchen ist mit dem Namen der zu säenden Bakterien und dem Datum gekennzeichnet. Jedes der Bakterien wird auf die Lünette ausgesät und 24 Stunden lang inkubiert. Sobald die Kolonien gewachsen sind, werden die Röhrchen bei Raumtemperatur gelagert.
Die Bakterioteca muss von 1 bis 3 Monaten erneuert werden, um eine Kontamination und Dehydrierung des Mediums sowie den Tod der Bakterien zu vermeiden.
Auf diese Weise können nur nicht wählerische Bakterien erhalten werden.
Kolonienzahl
Obwohl es spezielle Mittel zum Zählen von Kolonien gibt, wie beispielsweise Standardzählagar, kann Nähragar für diesen Zweck entweder durch Oberflächenaussaat mit einem Drigalski-Spatel oder durch Tiefe verwendet werden. Aus diesem Grund ist es sehr nützlich bei der mikrobiologischen Analyse von Lebensmitteln und Wasser..
Diagnosetests ausführen
Da es sich um ein Medium handelt, das kein Blut oder einen anderen Zusatzstoff enthält, ist es ideal, um auf diesem Medium gezüchtete Kolonien zur Durchführung des Katalasetests zu nehmen..
Ebenso ist es aufgrund seiner hellen Farbe angezeigt, Oxidasetests direkt auf einer Fläche des ausgesäten Agars ohne Störung durchzuführen..
Rückgewinnung von mesophilen Aeroben aus Salzwasser (Strände)
Der mit 10% Meerwasser hergestellte Nähragar ist nützlich für die Bewertung von mesophilen Aeroben in Strandgewässern..
Auf diese Weise kann der tatsächliche Grad der Kontamination des Wassers mit diesen Mikroorganismen erkannt werden, da bei dieser Art von Proben die Ergebnisse überlappen, wenn auf herkömmliche Weise hergestellte Kulturmedien verwendet werden..
Dies wurde von Cortez et al. im Jahr 2013 in einer Forschungsarbeit.
Dies kann durch die abrupte Veränderung erklärt werden, die Bakterien erfahren, wenn sie von einer hypersalzenen Umgebung in eine salzarme Umgebung übergehen. Daher geraten die Mikroorganismen in einen Zustand der Lethargie, in dem sie lebensfähig, aber nicht kultivierbar sind..
Verweise
- "Nähragar." Wikipedia, die freie Enzyklopädie. 13. September 2016, 20:33 UTC. 29. Dezember 2018, 21:04 Uhr en.wikipedia.org
- Forbes B., Sahm D., Weissfeld A. (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Argentinien. Editorial Panamericana S.A..
- Koneman E., Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. (5. Aufl.). Argentinien, Editorial Panamericana S.A..
- Cortez J., Ruiz Y., Medina L., Valbuena O. Wirkung von mit Meerwasser hergestellten Kulturmedien auf Gesundheitsindikatoren in Meeresgewässern von Spas in Chichiriviche, Bundesstaat Falcón, Venezuela. Rev Soc Ven Microbiol 2013; 33: 122-128
- Paredes V, Dias V, Silva de Almeida M und Cardoso M. Mikrobiologische Qualität von Wasser zur Besamung von Dosen bei Schweinen.Cient.Agro.Amaz. 2013; 1 (2): 42-49.
- García P., Paredes F., Fernández del Barrio M. (1994). Praktische klinische Mikrobiologie. Universität Cadiz, 2. Auflage. UCA Publications Service.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.