
Adenylatcyclase Eigenschaften, Typen, Funktionen
Das Adenylatcyclase oder Adenylcyclase ist das Enzym, das für die Umwandlung von ATP, einem hochenergetischen Molekül, in cyclisches AMP verantwortlich ist, ein wichtiges Signalmolekül, das verschiedene cyclisch abhängige AMP-Proteine mit wichtigen physiologischen Funktionen aktiviert.
Seine Aktivität wird durch verschiedene Faktoren gesteuert, wie zum Beispiel die konzertierte Wirkung von Hormonen, Neurotransmittern und anderen regulatorischen Molekülen unterschiedlicher Natur (zweiwertige Calciumionen und G-Proteine, um nur einige zu nennen)..
Die Hauptbedeutung dieses Enzyms liegt in der Bedeutung des Produkts der von ihm katalysierten Reaktion, des zyklischen AMP, da es an der Kontrolle vieler zellulärer Phänomene im Zusammenhang mit Metabolismus und Entwicklung sowie an der Reaktion auf verschiedene externe Reize beteiligt ist..
In der Natur verwenden sowohl einzellige Organismen (relativ einfach) als auch große und komplexe mehrzellige Tiere cyclisches AMP als zweiten Botenstoff und damit die Enzyme, die es produzieren..
Phylogenetische Studien belegen, dass diese Enzyme vor der Trennung von Eubakterien und Eukaryoten von einem gemeinsamen Vorfahren stammen, was darauf hindeutet, dass cyclisches AMP unterschiedliche Funktionen hatte, möglicherweise im Zusammenhang mit der ATP-Produktion..
Eine solche Aussage kann akzeptiert werden, da die durch Adenylatcyclase katalysierte Reaktion leicht reversibel ist, was bei der Gleichgewichtskonstante für die ATP-Synthese festgestellt werden kann (K.Gl ≤ 2,1 ± 0,2 10-9 M.zwei).
Artikelverzeichnis
- 1 Eigenschaften und Struktur
- 1.1 Strukturelle Eigenschaften
- 1.2 Katalytische Stelle
- 1.3 Standort
- 2 Arten
- 2.1 Adenylatcyclasen von Säugetieren
- 3 Funktionen
- 4 Verordnung
- 5 Referenzen
Eigenschaften und Struktur
Die meisten eukaryotischen Adenylatcyclaseenzyme sind mit der Plasmamembran assoziiert, aber in Bakterien und Säugetierspermien werden sie als lösliche Proteine im Cytosol gefunden.
In Hefen und einigen Bakterien sind sie periphere Membranproteine, während sie in bestimmten Amöbenarten Moleküle mit einem einzigen Transmembransegment sind.
Strukturelle Eigenschaften
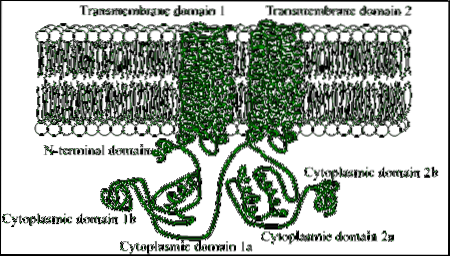
Es handelt sich um Proteine, die aus großen Polypeptidketten (mit mehr als 1.000 Aminosäureresten) bestehen und die Plasmamembran 12 Mal durch zwei Regionen durchqueren, die aus sechs Transmembrandomänen mit Alpha-Helix-Konformation bestehen..
Jede Transmembranregion ist durch eine große cytosolische Domäne getrennt, die für die katalytische Aktivität verantwortlich ist..
Unter den eukaryotischen Organismen gibt es einige konservierte Motive in einem Fragment der aminoterminalen Region dieser Enzyme sowie eine cytoplasmatische Domäne von etwa 40 kDa, die durch die hydrophoben Abschnitte begrenzt ist.
Katalytische Stelle
Die Reaktion, die diese Enzyme katalysieren, dh die Bildung einer Diesterbindung durch einen nukleophilen Angriff der OH-Gruppe in Position 3 'auf die Phosphatgruppe des Nucleosidtriphosphats in Position 5', hängt von einem gemeinsamen Strukturmotiv ab, das als das bekannt ist Domain Palm ".
Diese Domäne von "Palme" besteht aus einem Motiv "βαβααβ"(" Β "bedeutet die β-gefalteten Schichten und" α "die Alpha-Helices) und weist zwei invariante Asparaginsäurereste auf, die die beiden für die Katalyse verantwortlichen Metallionen koordinieren, bei denen es sich um zweiwertiges Magnesium oder Magnesiumionen handeln kann. Zink.
Viele Studien zur Quartärstruktur dieser Enzyme haben gezeigt, dass ihre katalytische Einheit als Dimer vorliegt, dessen Bildung von den Transmembransegmenten abhängt, die sich während der Bildung des Proteins im endoplasmatischen Retikulum verbinden..
Ort
Es wurde festgestellt, dass Adenylcyclasen wie viele integrale Membranproteine wie G-Proteine, solche mit Phosphatidylinositol-Ankern und viele andere in speziellen Membranregionen oder Mikrodomänen gefunden werden, die als "Lipidflöße" bekannt sind (aus dem Englischen) "Lipidfloß").
Diese Membrandomänen können einen Durchmesser von bis zu Hunderten von Nanometern haben und bestehen hauptsächlich aus Cholesterin und Sphingolipiden mit langen und überwiegend gesättigten Fettsäureketten, wodurch sie weniger flüssig werden und Transmembransegmente verschiedener Proteine aufnehmen können.
Adenylatcyclasen wurden auch in Verbindung mit Subregionen von Lipidflößen gefunden, die als "Caveolae" bekannt sind (aus dem Englischen).Caveolae "), die eher Invaginationen der cholesterinreichen Membran und eines damit verbundenen Proteins namens Caveolin sind.
Typen
In der Natur gibt es drei genau definierte Klassen von Adenylatcyclase und zwei, die derzeit diskutiert werden..
- Klasse I: Sie sind in vielen gramnegativen Bakterien wie z E coli, Zum Beispiel, wenn das cyclische AMP-Produkt der Reaktion als Ligand für Transkriptionsfaktoren fungiert, die für die Regulation katabolischer Operons verantwortlich sind.
- Klasse II: gefunden in einigen Krankheitserregern von Bakteriengattungen wie Bazillus oder Bordetella, wo sie als extrazelluläre Toxine dienen. Sie sind Proteine, die durch Wirts-Calmodulin aktiviert werden (in Bakterien nicht vorhanden)..
- Klasse III: Diese sind als "universelle" Klasse bekannt und phylogenetisch mit Guanylatcyclasen verwandt, die ähnliche Funktionen erfüllen. Sie kommen sowohl in Prokaryoten als auch in Eukaryoten vor, wo sie auf verschiedenen Wegen reguliert werden.
Säugetieradenylatcyclasen
Bei Säugetieren wurden mindestens neun Arten dieser Enzyme kloniert und beschrieben, die von neun unabhängigen Genen codiert werden und zur Adenylcyclase der Klasse III gehören.
Sie teilen komplexe Strukturen und Membrantopologien sowie doppelte katalytische Domänen, die für sie charakteristisch sind..
Bei Säugetieren entspricht die Nomenklatur für Isoformen den Buchstaben AC (z Adenylatcyclase) und eine Zahl von 1 bis 9 (AC1 - AC9). Es wurden auch zwei Varianten des AC8-Enzyms berichtet.
Die in diesen Tieren vorhandenen Isoformen sind hinsichtlich der Sequenz der Primärstruktur ihrer katalytischen Stellen und der dreidimensionalen Struktur homolog. Der Einschluss eines dieser Enzyme in jeden "Typ" hängt hauptsächlich mit den Regulationsmechanismen zusammen, die auf jede Isoform wirken.
Sie haben Expressionsmuster, die oft gewebespezifisch sind. Alle Isoformen können im Gehirn gefunden werden, obwohl einige auf bestimmte Bereiche des Zentralnervensystems beschränkt sind.
Eigenschaften
Die Hauptfunktion der zur Adenylatcyclase-Familie gehörenden Enzyme besteht darin, ATP in cyclisches AMP umzuwandeln, und dafür katalysieren sie die Bildung einer intramolekularen 3'-5'-Diesterbindung (Reaktion ähnlich der durch DNA-Polymerasen katalysierten) mit der Freisetzung eines Pyrophosphatmoleküls.
Bei Säugetieren wurden die verschiedenen Varianten, die erreicht werden können, mit Zellproliferation, Ethanolabhängigkeit, synaptischer Plastizität, Drogenabhängigkeit, zirkadianem Rhythmus, olfaktorischer Stimulation, Lernen und Gedächtnis in Verbindung gebracht..
Einige Autoren haben vorgeschlagen, dass Adenylatcyclasen eine zusätzliche Funktion als Transportermoleküle oder, wie auch immer, als Kanalproteine und Ionentransporter haben könnten..
Diese Hypothesen wurden jedoch nur auf der Grundlage der Anordnung oder Topologie der Transmembransegmente dieser Enzyme getestet, die einige Homologien oder strukturelle Ähnlichkeiten (aber keine Sequenz) mit bestimmten Ionentransportkanälen aufweisen..
Sowohl cyclisches AMP als auch PPi (Pyrophosphat), die die Produkte der Reaktion sind, haben Funktionen auf zellulärer Ebene; Ihre Bedeutung hängt jedoch vom Organismus ab, in dem sie sich befinden.
Verordnung
Die große strukturelle Vielfalt unter den Adenylcyclasen zeigt eine große Anfälligkeit für mehrere Formen der Regulation, die es ihnen ermöglicht, sich in eine Vielzahl von zellulären Signalwegen zu integrieren..
Die katalytische Aktivität einiger dieser Enzyme hängt von Alpha-Ketosäuren ab, während andere viel komplexere Regulationsmechanismen aufweisen, die regulatorische Untereinheiten (durch Stimulation oder Hemmung) umfassen, die beispielsweise von Calcium und anderen allgemein löslichen Faktoren sowie von anderen abhängen Proteine.
Viele Adenylatcyclasen werden durch Untereinheiten einiger G-Proteine negativ reguliert (hemmen ihre Funktion), während andere aktivierendere Wirkungen ausüben.
Verweise
- Cooper, D.M.F. (2003). Regulation und Organisation von Adenylylcyclasen und cAMP. Biochemical Journal, 375, 517-529.
- Cooper, D., Mons, N. & Karpen, J. (1995). Adenylylcyclasen und die Wechselwirkung zwischen Calcium- und cAMP-Signalen. Natur, 374, 421-424.
- Danchin, A. (1993). Phylogenie von Adenylylcyclasen. Fortschritte in der Second Messenger- und Phosphoproteinforschung, 27, 109-135.
- Hanoune, J. & Defer, N. (2001). Regulation und Rolle von Adenylylcyclase-Isoformen. Ann. Rev. Pharmacol. Toxicol., 41, 145-174.
- Linder, U. & Schultz, J. E. (2003). Die Adenylylcyclasen der Klasse III: Mehrzweck-Signalmodule. Zelluläre Signalisierung, fünfzehn, 1081-1089.
- Tang, W. & Gilman, A. G. (1992). Adenylylcyclasen. Zelle, 70, 669-672.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.