
Acetonitril (C2H3N) Struktur, Eigenschaften, Verwendung
Das Acetonitril Es ist eine Substanz organischen Ursprungs, die nur aus Kohlenstoff, Wasserstoff und Stickstoff besteht. Diese chemische Spezies gehört zur Gruppe der Nitrile, wobei Acetonitril diejenige mit der einfachsten Struktur unter denen des organischen Typs ist..
Nitrile sind eine Klasse chemischer Verbindungen, deren Struktur aus einer Cyanidgruppe (CN) besteht-) und eine Radikalkette (-R). Diese Elemente werden durch die folgende allgemeine Formel dargestellt: R-C≡N.
Es ist bekannt, dass diese Substanz hauptsächlich bei der Herstellung einer anderen Spezies namens Acrylnitril (einem anderen einfachen Nitril der Summenformel C) entsteht3H.3N, das bei der Herstellung von Produkten in der Textilindustrie verwendet wird) als Nebenprodukt derselben.
Darüber hinaus wird Acetonitril als Lösungsmittel mit mittleren Polaritätseigenschaften angesehen, weshalb es ziemlich regelmäßig in RP-HPLC-Analysen (Umkehrphasen-Hochleistungsflüssigchromatographie) verwendet wird..
Artikelverzeichnis
- 1 Struktur
- 2 Eigenschaften
- 3 Verwendungen
- 4 Risiken
- 5 Referenzen
Struktur
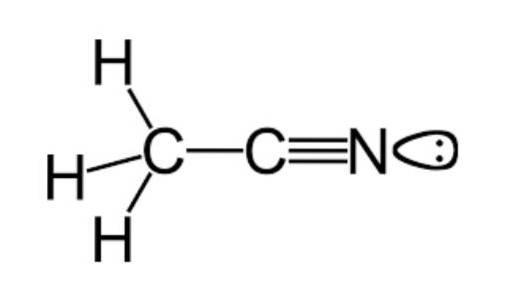
Wie zuvor erwähnt, gehört Acetonitril zur funktionellen Gruppe der Nitrile mit einer Summenformel, die üblicherweise als C dargestellt wirdzweiH.3N, was in der Strukturformel zu sehen ist, die in der oberen Abbildung beispielhaft dargestellt ist.
Dieses Bild zeigt eine Art Lappen, die an das Stickstoffatom gebunden ist, das das Paar ungepaarter Elektronen darstellt, das dieses Atom besitzt, und das ihm einen großen Teil der für es charakteristischen Reaktivitäts- und Stabilitätseigenschaften verleiht..
Auf diese Weise zeigt diese Spezies aufgrund ihrer strukturellen Anordnung ein ganz besonderes Verhalten, das sich in einer Schwäche für den Erhalt von Wasserstoffbrückenbindungen und einer geringen Fähigkeit zur Abgabe von Elektronen niederschlägt..
Diese Substanz entstand zum ersten Mal in der zweiten Hälfte der 1840er Jahre und wurde von dem Wissenschaftler Jean-Baptiste Dumas hergestellt, dessen Nationalität französisch war.
Die strukturelle Konformation dieser Substanz ermöglicht es ihr, die Eigenschaften ihres eigenen Lösungsmittels organischer Natur zu haben..
Diese Eigenschaft ermöglicht es wiederum, Acetonitril mit Wasser sowie einer Reihe anderer Lösungsmittel organischen Ursprungs zu mischen, mit Ausnahme von Kohlenwasserstoffen oder gesättigten Kohlenwasserstoffspezies..
Eigenschaften
Diese Verbindung weist eine Reihe von Eigenschaften auf, die sie von anderen derselben Klasse unterscheiden, die nachstehend aufgeführt sind:
- Es befindet sich unter normalen Druck- und Temperaturbedingungen (1 atm und 25 ° C) in einem flüssigen Aggregatzustand..
- Seine molekulare Konfiguration ergibt eine Molmasse oder ein Molekulargewicht von ungefähr 41 g / mol.
- Es wird als das Nitril angesehen, das unter den organischen Typen die einfachste Struktur aufweist.
- Seine optischen Eigenschaften ermöglichen es ihm, in dieser flüssigen Phase farblos und mit klaren Eigenschaften zu sein und zusätzlich einen aromatischen Geruch zu haben..
- Es hat einen Flammpunkt von etwa 2 ° C, was 275,1 K entspricht.
- Es hat einen Siedepunkt im Bereich von 81,3 bis 82,1ºC, eine Dichte von ungefähr 0,786 g / cm3 und einen Schmelzpunkt, der zwischen -46 bis -44ºC liegt.
- Es ist weniger dicht als Wasser, aber damit und mit einer Vielzahl organischer Lösungsmittel mischbar.
- Es zeigt eine Dielektrizitätskonstante von 38,8 zusätzlich zu einem Dipolmoment von ungefähr 3,92 D..
- Es ist in der Lage, eine Vielzahl von Substanzen ionischen Ursprungs und unpolarer Natur aufzulösen.
- Es wird häufig als mobile Phase in der HPLC-Analyse verwendet, die hohe Entflammbarkeitseigenschaften aufweist.
Anwendungen
Unter der großen Anzahl von Anwendungen, die Acetonitril hat, kann Folgendes gezählt werden:
- In ähnlicher Weise können andere Arten von Nitrilen in Mikrosomen (vesikuläre Elemente, die Teil der Leber sind), insbesondere in diesem Organ, einen Metabolisierungsprozess durchlaufen, um Blausäure zu produzieren..
- Es wird häufig als mobile Phase in der Art der Analyse verwendet, die als Umkehrphasen-Hochleistungsflüssigchromatographie (RP-HPLC) bezeichnet wird. das heißt, als eluierende Substanz, die eine hohe Stabilität, eine große Elutionskraft und eine niedrige Viskosität aufweist.
- Bei Anwendungen von industrieller Größe wird diese chemische Verbindung in Rohölraffinerien als Lösungsmittel in bestimmten Prozessen verwendet, beispielsweise bei der Reinigung des als Butadien bezeichneten Alkens..
- Es wird auch als Ligand (chemische Spezies, die sich mit einem Atom eines metallischen Elements verbindet, das im gegebenen Molekül als zentral angesehen wird, um eine Verbindung oder einen Koordinationskomplex zu bilden) in einer großen Anzahl von Nitrilverbindungen mit Metallen der Übergangsgruppe verwendet.
- In ähnlicher Weise wird es in der organischen Synthese für eine große Anzahl solcher vorteilhafter Chemikalien wie α-Naphthalinessigsäure, Thiamin oder Acetamidinhydrochlorid verwendet..
Risiken
Die mit der Exposition gegenüber Acetonitril verbundenen Risiken sind vielfältig. Unter diesen ist eine verringerte Toxizität, wenn die Exposition für einen reduzierten Zeitraum und in geringen Mengen erfolgt und zur Herstellung von Blausäure metabolisiert wird..
Ebenso wurden selten Fälle registriert, in denen Menschen, die mit dieser chemischen Spezies vergiftet wurden und durch das im Molekül vorhandene Cyanid vergiftet wurden, nachdem sie in unterschiedlichem Maße mit Acetonitril in Kontakt gekommen waren (beim Einatmen, Verschlucken oder Absorbieren über die Haut)..
Aus diesem Grund verzögern sich die Folgen seiner Toxizität, da der Körper diese Substanz nicht leicht in Cyanid umwandelt, da dies zwei bis zwölf Stunden dauert..
Acetonitril wird jedoch leicht aus der Lunge und dem Magen-Darm-Trakt resorbiert. Anschließend erfolgt seine Verteilung im gesamten Körper, bei Menschen und sogar bei Tieren und bis zu Nieren und Milz..
Andererseits ist Acetonitril zusätzlich zu den damit verbundenen Entflammbarkeitsrisiken ein Vorläufer von Substanzen, die so giftig sind wie Blausäure oder Formaldehyd. Die Verwendung in Produkten aus dem Kosmetikbereich war im sogenannten Europäischen Wirtschaftsraum im Jahr 2000 sogar verboten..
Verweise
- Wikipedia. (s.f.). Acetonitril. Abgerufen von en.wikipedia.org
- PubChem. (s.f.). Acetonitril. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt
- Brown, P. R. (2000). Fortschritte in der Chromatographie. Erhalten von books.google.co.ve
- ScienceDirect. (s.f.). Acetonitril. Von sciencedirect.com abgerufen
- ChemSpider. (s.f.). Acetonitril. Von chemspider.com abgerufen



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.