
Natriumacetatstruktur, Eigenschaften, Synthese, Verwendung

Das Natriumacetat ist ein Natriumsalz der Essigsäure, dessen Summenformel C istzweiH.3ODERzweiN / A. Es besteht aus einem zerfließenden weißen Pulver, das im Wesentlichen in zwei Formen vorliegt: wasserfrei und trihydratisiert. Beide sind in Wasser, dem universellen Lösungsmittel, sehr gut löslich; aber nicht so löslich in Alkoholen oder Aceton.
Die wasserfreie Form hat eine Dichte, einen Schmelzpunkt und einen Siedepunkt mit höheren Werten als die Trihydratform von Natriumacetat. Dies liegt daran, dass die Wassermoleküle die Wechselwirkungen der Na-Ionen stören.+ und CH3GURREN-.

Natriumacetat ist stabil, insbesondere wenn es zwischen 2 und 8 ° C gelagert wird; es ist jedoch anfällig für die Einwirkung starker Oxidationsmittel und Halogene.
Es kann durch Umsetzung von Natriumbicarbonat mit Essigsäure hergestellt werden. Auch bei der Reaktion von Essigsäure mit Natriumhydroxid. Beide Reaktionen sind einfach herzustellen und kostengünstig; Das erste kann sogar zu Hause gemacht werden.
Dieses Salz ist eine wenig toxische Verbindung. Erzeugt Hautreizungen nur nach häufigem und kontinuierlichem Kontakt. Es ist leicht reizend für die Augen, kann aber die Atemwege reizen. Es gibt keine Informationen über eine schädliche Wirkung seiner Einnahme..
Es hat zahlreiche Anwendungen und Anwendungen, die zusammen mit Essigsäure seine pH-Pufferfunktion hervorheben. Der Acetatpuffer hat einen pKa = 4,7; Dies verleiht eine hohe Effizienz bei der pH-Regulierung in einer sauren Umgebung mit pH-Werten zwischen 3 und 6.
Aufgrund seiner geringen Toxizität und seiner Eigenschaften wurde es häufig zur Verbesserung des Geschmacks von Lebensmitteln sowie als Mittel verwendet, das aufgrund seiner Wirkung gegen Mikroben Schutz vor Verderb bietet..
Artikelverzeichnis
- 1 Struktur von Natriumacetat
- 1.1 Hydratisierte Kristalle
- 2 Eigenschaften
- 2.1 Namen
- 2,2 Molmasse
- 2.3 Aussehen
- 2.4 Geruch
- 2.5 Dichte
- 2.6 Schmelzpunkt
- 2.7 Siedepunkt
- 2.8 Löslichkeit
- 2.9 Säure
- 2.10 Basizität
- 2.11 Brechungsindex (ηD)
- 2.12 Kalorienkapazität
- 2.13 Flammpunkt
- 2.14 Selbstentzündungstemperatur
- 2,15 pH
- 2.16 Stabilität
- 2.17 Reaktionen
- 3 Synthese
- 4 Verwendungen
- 4.1 Thermobeutel
- 4.2 Industrie
- 4.3 Medizinische Verwendung
- 4,4 pH-Pufferlösung
- 4.5 Forschungslabors
- 4.6 Lebensmittelkonservierung
- 4.7 Konservierung von Beton
- 5 Experimente für junge Leute
- 5.1 Versuch 1
- 5.2 Versuch 2
- 6 Toxizität
- 7 Referenzen
Struktur von Natriumacetat
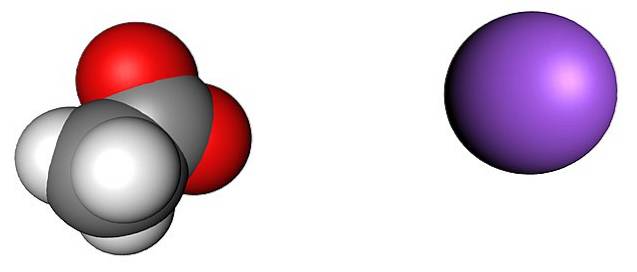
Das Bild oben zeigt die Ionen, aus denen wasserfreie Natriumacetatkristalle bestehen (ohne Wasser). Die violette Kugel entspricht dem Na-Kation+, und das Molekülion zu seiner Linken ist Acetat, CH3GURREN-, mit seinen Sauerstoffatomen durch rote Kugeln dargestellt.
Diese Paare nach der Formel CH3COONa stehen im Verhältnis 1: 1; für jedes CH-Anion3GURREN-, Es muss ein Na-Kation geben+ angezogen von seiner negativen Ladung und umgekehrt. Somit führen die Anziehungskräfte zwischen ihnen und die Abstoßungen zwischen gleichen Ladungen zu Strukturmustern, die einen Kristall definieren, dessen minimaler Ausdruck die Einheitszelle ist.
Diese Einheitszelle variiert wie der Kristall als Ganzes in Abhängigkeit von der Anordnung der Ionen im Raum; es ist nicht immer dasselbe, selbst für dasselbe kristalline System. Beispielsweise kann wasserfreies Natriumacetat zwei orthorhombische Polymorphe bilden, von denen eines nachstehend dargestellt ist:
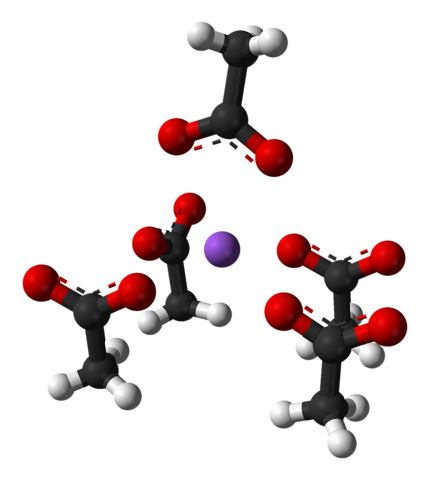
Beachten Sie die Anordnung der Ionen: vier CH-Ionen3GURREN- Sie sperren ein Na ein+ so, dass sie eine verzerrte quadratische Pyramide "zeichnen". Jeder dieser ch3GURREN- wiederum interagieren sie mit einem anderen Na+ benachbart.
Hydratisierte Kristalle
Natriumacetat hat eine hohe Affinität zu Wasser; in der Tat ist es zerfließend, das heißt, es speichert Feuchtigkeit, bis es sich darin auflöst. Je höher die Luftfeuchtigkeit, desto eher "schmilzt" es. Dies liegt daran, dass sowohl die CH3GURREN- wie Na+ kann hydratisieren, sich mit Wassermolekülen umgeben, die ihre Dipole auf ihre Ladungen ausrichten (Na+ Ohzwei, CH3GURREN- HOH).
Wenn dieses Salz im Labor oder zu Hause hergestellt wird, ist seine Affinität zu Wasser so, dass es selbst bei normalen Temperaturen bereits als Hydrat erhalten wird; das CH3COONa 3HzweiO. Seine Kristalle hören auf, orthorhombisch zu sein und werden monoklin, da sie jetzt drei Wassermoleküle für jedes CH-Paar enthalten3GURREN- und Na+.
Eigenschaften
Namen
-Natriumacetat.
-Natriumethanoat (IUPAC).
Molmasse
-Wasserfrei: 82,03 g / mol.
-Trihydrat: 136,03 g / mol.
Aussehen
Zerfließendes weißes Pulver.
Geruch
Zu Essig beim Erhitzen zur Zersetzung.
Dichte
-Wasserfrei: 1,528 g / cm3 bei 20 ºC.
-Trihydrat: 1,45 g / cm3 bei 20 ºC.
Schmelzpunkt
-Wasserfrei: 324ºC (615ºF, 597K).
-Trihydrat: 58 ºC (136 ºF, 331 K).
Siedepunkt
-Wasserfrei: 881,4 ºC (1,618,5 ºF, 1,154,5 K).
-Trihydrat: 122 ° C (252 ° F, 395 K). Es zersetzt sich.
Löslichkeit
Im Wasser
-Wasserfrei: 123,3 g / 100 ml bei 20 ° C..
-Trihydrat: 46,4 g / 100 ml bei 20 ° C..
In Methanol
16 g / 100 g bei 15 ºC.
In Ethanol
5,3 g / 100 ml (Trihydrat).
In Aceton
0,5 g / kg bei 15 ° C..
Säure
pKa: 24 (20 ºC).
Basizität
pKb: 9,25. Hier wird gezeigt, dass Natriumacetat ein basisches Salz ist, weil es weniger pKb als pKa hat.
Brechungsindex (ηD)
1.464
Kalorienkapazität
-100,83 J / mol K (wasserfrei).
-229,9 J / mol K (Trihydrat).
Zündpunkt
Über 250ºC.
Selbstentzündungstemperatur
600 ºC.
pH
8,9 (0,1 M Lösung bei 25 ° C).
Stabilität
Stabil. Unverträglich mit starken Oxidationsmitteln und Halogenen. Feuchtigkeitsempfindlich.
Reaktionen
Natriumacetat kann durch Umsetzung mit einem Alkylhalogenid einen Ester bilden; zum Beispiel Bromethan:
CH3COONa + BrCHzweiCH3 => CH3COOCHzweiCH3 + NaBr
Natriumacetat decarboxyliert in Gegenwart von NaOH zu Methan (Pyrolyse):
CH3COONa + NaOH => CH4 + N / AzweiCO3
Die Reaktion wird durch Cäsiumsalze katalysiert.
Synthese
Natriumacetat kann im Labor kostengünstig hergestellt werden, indem Natriumbicarbonat mit Essigsäure umgesetzt wird:
NaHCO3 + CH3COOH => CH3COONa + H.zweiCO3
Diese Reaktion wird von der Anwesenheit eines intensiven Blasens in der Lösung aufgrund der Zersetzung von Kohlensäure in Wasser und Kohlendioxid begleitet..
H.zweiCO3 => H.zweiO + COzwei
Industriell wird Natriumacetat durch Umsetzung von Essigsäure mit Natriumhydroxid hergestellt.
CH3COOH + NaOH => CH3COONa + H.zweiODER
Anwendungen
Thermobeutel
Natriumacetat wird zur Herstellung von Thermobeuteln verwendet.
Zu Beginn werden die Salzkristalle in einem Wasservolumen gelöst, um eine Lösung herzustellen, die übersättigt wird..
Dann wird die Lösung auf eine Temperatur von mehr als 58 ° C erhitzt, was ihrem Schmelzpunkt entspricht. Man lässt die übersättigte Lösung auf Raumtemperatur abkühlen und es wird keine Kristallbildung beobachtet; Die Lösung ist unterkühlt.
Das Fehlen von Kristallen erklärt sich aus der Tatsache, dass die Moleküle der Flüssigkeit zu ungeordnet sind und nicht die richtige Orientierung haben, um die Kristallisationstemperatur zu erreichen. Die Flüssigkeit befindet sich in einem metastabilen Zustand, einem Zustand des Ungleichgewichts.
Angesichts der Instabilität der unterkühlten Flüssigkeit reicht jede Störung aus, um die Kristallisation auszulösen. Im Fall von Thermobeuteln wird ein mechanischer Aufsatz gedrückt, um die Flüssigkeit zu rühren und die Bildung von Kristallen und die Verfestigung der Natriumacetat-Trihydratlösung zu initiieren..
Mit zunehmender Kristallisation steigt die Temperatur an. Natriumacetat-Trihydratkristalle sehen aus wie Eis, sind aber heiß, weshalb sie als "heißes Eis" bezeichnet werden..
Industriell
-Natriumacetat wird in der Textilindustrie als Beizmittel beim Färben von Stoffen verwendet
-Neutralisiert Schwefelsäureabfälle
-Es wird bei der Verarbeitung von Baumwolle zur Herstellung von Wattepads verwendet, die zur persönlichen Reinigung und für medizinische Zwecke verwendet werden können
-Es wird beim Beizen von Metallen vor ihrer Verchromung verwendet
-Arbeitet zusammen, damit bei der Herstellung von Synthesekautschuk keine Chloroprenvulkanisation auftritt
-Eingreift in die Reinigung von Glukose
-Es wird beim Gerben von Leder verwendet.
Medizinische Verwendung
Natriumacetat ist eine der Verbindungen, die zur intravenösen Verabreichung von Elektrolyten an Patienten verwendet werden..
Es wird verwendet, um den Natriumspiegel bei hyponaträmischen Patienten zu korrigieren, auch bei der Korrektur der metabolischen Azidose und der Alkalisierung des Urins..
PH-Pufferlösung
Es wird als pH-Regler in vielen enzymatischen Reaktionen verwendet, die zwischen pH 3 und pH 6 auftreten.
Der unterschiedliche pH-Wert der Acetatpufferlösung wird durch Variation der Konzentration von Essigsäure und Natriumacetat erreicht..
Um beispielsweise einen pH-Wert von 4,5 zu erhalten, hat die Pufferlösung eine Essigsäurekonzentration von 3,8 g / l und eine wasserfreie Natriumacetatkonzentration von 3,0 g / l..
Die Konzentration des Acetatpuffers kann erhöht werden, wobei die zur Erzielung des gewünschten pH-Werts erforderlichen Bestandteile der Lösung im gleichen Verhältnis erhöht werden.
Acetat / Acetonitril-Puffer wird in der Kapillarelektrophorese bei der Trennung von Photoberberinen verwendet.
Forschungslabors
-Natriumacetat ist ein schwaches nukleophiles Mittel, das bei der anionischen Polymerisation von β-Lacton verwendet wird.
-Es wird als Reagenz in der Kernspinresonanz von biologischen Makromolekülen verwendet.
-Es wird bei der Extraktion von DNA aus Zellen verwendet. Natrium ist ein Kation, das mit den negativen Ladungen der in der DNA vorhandenen Phosphate interagiert und deren Kondensation unterstützt. In Gegenwart von Ethanol bildet DNA einen Niederschlag, der sich dann in die wässrige Schicht trennen kann.
Lebensmittelkonservierung
-Verhindert das Wachstum von Bakterien und verhindert die Bildung von überschüssiger Säure, die zum Verderben von Lebensmitteln führt, wodurch ein spezifischer pH-Wert aufrechterhalten wird.
-Das in Acetat enthaltene Natrium verbessert den Geschmack von Lebensmitteln.
-Natriumacetat wird zur Herstellung von eingelegtem Gemüse verwendet: Gurke, Karotte, Zwiebel usw. Darüber hinaus wird es zur Konservierung von Fleisch verwendet.
Erhaltung von Beton
Beton wird durch die Einwirkung von Wasser beschädigt, was seine Dauer verkürzt. Natriumacetat wirkt als Betonversiegelungsmittel, das es wasserdicht macht und seine ursprünglichen Eigenschaften verlängert.
Jugendversuche
Versuch 1
Ein einfaches Experiment ist die Synthese von Natriumacetat durch Umsetzung von Natriumbicarbonat mit Essig (5% Essigsäure)..
30 ml Essig werden in ein Becherglas gegeben und ungefähr 3,5 g Bicarbonat werden zugegeben..
Bei der Reaktion entstehen Natriumacetat und Kohlensäure. Säure zerfällt in Kohlendioxid und Wasser. Die Erzeugung von Kohlendioxid erzeugt ein intensives Blasen in der Lösung.
Um das Natriumacetat zu sammeln, verdampft das Wasser und erhitzt die Lösung.
Experiment 2
Ein weiteres einfaches Experiment ist die Bildung von Kristallen aus Natriumacetat-Trihydrat.
Dazu werden etwa 20 g Natriumacetat-Trihydrat gewogen und in ein Becherglas gegeben, dann werden 10 ml Wasser zugegeben. Die Lösung wird auf eine Temperatur über 58 ºC erhitzt.
Natriumacetat wird vollständig gelöst, um sicherzustellen, dass die Lösung übersättigt ist. Zuvor wurde eine Pietri-Schale auf eine kalte Oberfläche gestellt.
Der Inhalt des Bechers mit dem Acetat-Trihydrat wird langsam in die Pietri-Schale gegossen. Die Temperatur der Flüssigkeit in der Kapsel beginnt sogar unter den Schmelzpunkt zu fallen, ohne die Kristallisation oder Verfestigung des Natriumacetat-Trihydrats zu beobachten..
Üblicherweise wird zur Erzeugung der Kristallisation des Natriumacetat-Trihydrats eine kleine Menge des Salzes zugesetzt, um als Kristallisationskern zu dienen. In anderen Fällen tritt eine kleine Störung der Lösung auf, um die Kristallisation von Natriumacetat zu initiieren.
Natriumacetat-Trihydratkristalle haben das Aussehen von Eis, aber wenn Sie sie berühren, werden Sie feststellen, dass sie relativ heiß sind. Aus diesem Grund wird Salz "heißes Eis" genannt..
Toxizität
Natriumacetat ist eine sehr wenig toxische Verbindung. Es ist auch nicht als Haut- und Atemwegssensibilisator klassifiziert..
Darüber hinaus wird Natriumacetat nicht als mutagenes, krebserzeugendes oder reproduktionstoxisches Mittel für Keimzellen eingestuft..
Kurz gesagt, es ist leicht reizend für die Augen. Die Atemwege können nach Einatmen gereizt werden. Häufiger und ständiger Kontakt mit der Haut kann zu Reizungen führen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- WorldOfChemicals. (16. Januar 2017). Wie zu Hause Natriumacetat zubereiten? Wiederhergestellt von: medium.com
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Natriumacetat. PubChem-Datenbank. CID = 517045. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan und M. O. Rahman. (1976). Die Kristallstruktur von Natriumacetat-Trihydrat. Acta Cryst. B32, 87.
- Wikipedia. (2019). Natriumacetat. Wiederhergestellt von: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24. Januar 2019). Machen Sie heißes Eis aus Essig und Backpulver. Wiederhergestellt von :oughtco.com
- Chemisches Buch. (2017). Natriumacetat. Wiederhergestellt von: Chemicalbook.com
- Wasserman Robin. (2019). Verwendung von Natriumacetat. Wiederhergestellt von: livestrong.com
- Drogenbank. (2019). Natriumacetat. Wiederhergestellt von: drugbank.ca


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.