
Kaliumacetatstruktur, Eigenschaften, Verwendung, Herstellung
Das Kaliumacetat ist eine organische Verbindung, die von einem Kalium-K-Ion gebildet wird+ und ein Acetation CH3GURREN-. Seine chemische Formel lautet CH3KOCH oder KCH3COO oder auch C.zweiH.3KOzwei. Es ist ein farbloser oder weißer kristalliner Feststoff, der in Wasser sehr gut löslich ist..
Es wird verwendet, um den Säuregehalt bestimmter industriell verarbeiteter Lebensmittel zu regulieren. Aufgrund seiner großen Affinität zu Wasser wird es in Laboratorien oder in bestimmten Prozessen verwendet, um Wasser aus anderen Verbindungen zu absorbieren, beispielsweise um Alkohol zu dehydrieren..

Kaliumacetat ist an einigen chemischen Reaktionen als Beschleuniger dieser und an der Synthese organischer Verbindungen beteiligt. Es ermöglicht auch die Erhöhung der Bildung von Antikörpern (natürlichen Substanzen, die Infektionen bekämpfen) in industriellen Methoden, um sie herzustellen..
Aufgrund seiner sehr niedrigen Temperatureigenschaften ist es ein guter Kandidat für die Verwendung in Eisschmelzmischungen auf Betonstraßen in sehr kalten Klimazonen. Nach konsultierten Quellen wird es auch in Feuerlöschgeräten und in Baugruppen zur Beobachtung von Zellen in Mikroskopen eingesetzt..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3,6 pH
- 3.7 Andere Eigenschaften
- 3.8 Verhalten beim Aufheizen
- 4 Erhalten
- 5 Verwendungen
- 5.1 In verschiedenen Anwendungen
- 5.2 In der Polymerindustrie
- 5.3 In wissenschaftlichen und medizinischen Forschungslabors
- 5.4 Bei der industriellen Herstellung von Antikörpern
- 5.5 In Frostschutzmittelmischungen
- 5.6 Wie es als Frostschutzmittel funktioniert
- 6 Referenzen
Struktur
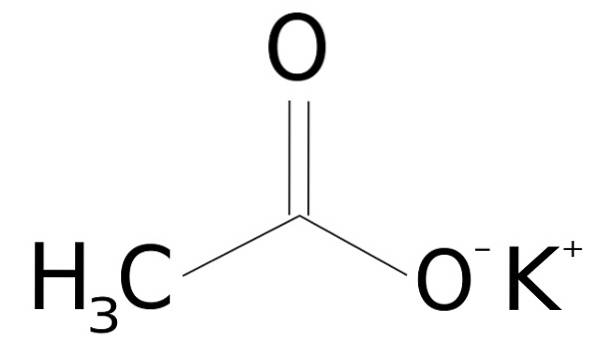
Kaliumacetat besteht aus einem Kalium-K-Kation+ und ein Acetatanion CH3GURREN-. Letzteres ist die konjugierte Base von Essigsäure CH3COOH. Das Acetation CH3GURREN- besteht aus einem Methyl-CH3 gebunden an ein Carboxylat-COO-.
Die Vereinigung zwischen beiden Ionen ist elektrostatisch oder ionisch, dh die Vereinigung zwischen einem positiven und einem negativen Ion.
Nomenklatur
- Kaliumacetat
- Kaliumethanoat
- Kaliumsalz der Essigsäure
- AcOK
- KOAc
Eigenschaften
Körperlicher Status
Farbloser oder weißer kristalliner Feststoff.
Molekulargewicht
98,14 g / mol
Schmelzpunkt
292 ºC
Dichte
1,6 g / cm3
Löslichkeit
In Wasser sehr gut löslich: 256 g / 100 ml bei 20 ° C..
pH
Eine 5% ige wässrige Lösung von Kaliumacetat hat einen pH-Wert von 7,5 bis 9,0.
Andere Eigenschaften
Manchmal riecht es schwach nach Essig. In 10% iger Lösung greift es Aluminium bei Raumtemperatur nicht an, aber bei 60-70 ° C verdunkelt sich das Metall und leidet unter Lochfraß.
Bei Konzentrationen von 20% oder mehr tritt bei jeder Temperatur ein Oberflächenangriff auf Aluminium auf.
Kaliumacetat (AcOK) ist in Wasser gut löslich. Es hat ein Hydrat: KCH3COO.1,5HzweiOder welches der Feststoff ist, der durch Kristallisieren aus den wässrigen Lösungen von AcOK erhalten wird.
Verhalten beim Erhitzen
Wenn das hydratisierte Kaliumacetat (AcOK) (KCH3COO.1,5HzweiO) Wenn es 40 ° C erreicht, beginnt es, das Hydratationswasser zu verlieren.
KCH3COO.1,5HzweiO → KCH3COO + 1,5HzweiOder ↑
Wenn wasserfreies Kaliumacetat erhitzt wird (ohne Wasser: KCH3COO) beginnt es bei Erreichen von 340 ° C, sich unter Bildung von Kaliumcarbonat K zu zersetzenzweiCO3 nach folgender Reaktion:
2 KCH3COO + 4 O.zwei → K.zweiCO3 + 3 H.zweiO + 3 COzwei↑
Erhalten
Es kann durch Einwirkung von Kaliumhydroxid KOH auf verschiedene Verbindungen wie Essigsäure CH hergestellt werden3COOH, Essigsäureanhydrid (CH3CO)zweiO und Ammoniumacetat CH3COONH4.
KOH + CH3COOH → CH3KOCH + H.zweiODER
Es kann auch durch Umsetzung von Kaliumcarbonat K erhalten werdenzweiCO3 oder KHCO Kaliumbicarbonat3 mit Essigsäure CH3COOH.
KHCO3 + CH3COOH → CH3KOCH + H.zweiO + COzwei↑
Kaliumacetat kann aus wässriger Lösung kristallisiert werden, um eine hohe Reinheit zu erhalten.
Anwendungen
In verschiedenen Anwendungen
Kaliumacetat wird in der verarbeiteten Lebensmittelindustrie als Säureregulator eingesetzt. Es wird als Trockenmittel in chemischen Verfahren verwendet, um die Wasserdampfdurchlässigkeit einiger Stoffe zu messen..
Es dient als Dehydratisierungsmittel für Ethanol bei der Herstellung dieses Alkohols ausgehend von Lignocellulose, einem aus Holz gewonnenen Material..
Es wird zur Herstellung von Antibiotika verwendet und ist in Feuerlöschgeräten weit verbreitet.
In der Polymerindustrie
Es wird verwendet, um Polyurethane zu recyceln, da es dazu dient, die Hydrolyse- und Glykolyse-Reaktionen der Polymere zu katalysieren oder zu beschleunigen, so dass sie zu Alkoholen und Aminen werden.
Es wird auch zur Herstellung von organischen Silikonharzen verwendet.
In wissenschaftlichen und medizinischen Forschungslabors
Hochreines Kaliumacetat wird in Laboratorien als Reagenz in der analytischen Chemie verwendet. Auch um medizinisch-wissenschaftliche Forschung zu betreiben.
In histopathologischen Labors wird es verwendet, um ein neutrales pH-Medium in Mikroskopaufbauten sicherzustellen..

Es wird zur Synthese von heterocyclischen organischen Verbindungen verwendet, bei denen es sich um Verbindungen mit unterschiedlichen Größenzyklen handelt..
Bestimmte Mikroelektroden, die zur Untersuchung der elektrischen Eigenschaften von Zellen verwendet werden, sind mit einer konzentrierten Lösung von Kaliumacetat gefüllt..
Bei der industriellen Herstellung von Antikörpern
Kaliumacetat wird zur großtechnischen Herstellung von monoklonalen Antikörpern (die aus derselben Stammzelle stammen) in Zellkulturen verwendet. Ermöglicht die Stimulierung der Synthese oder Bildung von Antikörpern.
Antikörper sind Substanzen, die von einigen Zellen im Blut produziert werden, um Infektionen durch Viren oder Bakterien zu bekämpfen..

In Frostschutzmischungen
Kaliumacetat wurde in Frostschutzmischungen verwendet. Vereisungsschutz), um damit Eis auf Straßen und Zementbelägen zu schmelzen und damit sicher zu verwenden.

Die Auswahl von Kaliumacetat (AcOK) für diese Anwendung beruht auf der Tatsache, dass eine 50 Gew .-% ige wässrige Lösung von AcOK eutektisch ist und einen Schmelzpunkt von -62 ° C aufweist. Dies bedeutet, dass die Lösung auch bei Temperaturen von bis zu -62 ° C geschmolzen bleibt..
Ein Eutektikum ist ein homogenes Gemisch von Komponenten, das den niedrigsten Schmelzpunkt aller möglichen Gemische davon aufweist, einschließlich desjenigen der reinen Komponenten..
Wie es als Frostschutzmittel funktioniert
Kaliumacetat (AcOK) hat eine sehr gute Fähigkeit, Eis zu schmelzen.
Bei -5 ° C kann es 11,5 kg Eis pro kg AcOK schmelzen. Diese Eigenschaft nimmt mit abnehmender Temperatur ab, kann aber selbst bei -50 ° C 1,3 kg Eis pro kg AcOH schmelzen..
Bei -5 ° C ist diese Kapazität vergleichbar mit der von Natriumchlorid oder Tafelsalz (NaCl), während sie ab -30 ° C weit überschritten wird.

Bei den mit AcOK zusammen mit anderen Verbindungen durchgeführten Tests wurde jedoch ein gewisser Korrosionsgrad der Zementoberflächen beobachtet, so dass in Betracht gezogen wurde, den Frostschutzmischungen Korrosionsschutzmittel zuzusetzen..
Andererseits ist die Mischung aus Kaliumacetat (CH3COOK) mit Kaliumformiat (HCOOK) ist ein ausgezeichnetes Frostschutzmittel und erfordert kein Korrosionsschutzmittel.
Verweise
- Baker, F.J. et al. (1976). Färbeverfahren. Wässrige Mountants. In Einführung in die medizinische Labortechnik (5. Auflage). Von sciencedirect.com wiederhergestellt.
- Hassan, A.A. et al. (2018). Indazole: Synthese und bindungsbildende Heterocyclisierung. Fortschritte in der heterocyclischen Chemie. Von sciencedirect.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Kaliumacetat. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Das, A. und Alagirusamy, R. (2010). Feuchtigkeitsübertragung. Umgekehrte Trockenmittelbecher-Methode. In der Wissenschaft im Kleidungskomfort. Von sciencedirect.com wiederhergestellt.
- Vargel, C. (2004). Carbonsäuren und ihre Derivate. Acetate. Bei der Korrosion von Aluminium. Von sciencedirect.com wiederhergestellt.
- Cuevas, J. (2014). Elektrophysiologische Aufnahmetechniken. Intrazelluläre Aufnahmetechniken. Im Referenzmodul in Biomedizinischen Wissenschaften. Von sciencedirect.com wiederhergestellt.
- Fink, J.K. (2018). Poly (urethan) s. Recycling. Solvolysis. In reaktiven Polymeren: Grundlagen und Anwendungen (dritte Ausgabe). Von sciencedirect.com wiederhergestellt.
- Fong, W. et al. (1997). Optimierung der Produktion monoklonaler Antikörper: kombinierte Effekte von Kaliumacetat und Perfusion in einem Rührkessel-Bioreaktor. Cytotechnology 24: 47 & ndash; 54. Von link.springer.com wiederhergestellt.
- Danilov, V.P. et al. (2012). Niedertemperatur-Vereisungsreagenzien in wässrigen Salzsystemen, die Acetate und Formiatate enthalten. Theoretical Foundations of Chemical Engineering, 2012, Band 46, Nr. 5, S. 528-535. Von link.springer.com wiederhergestellt.
- Fakeev, A. A. et al. (2012). Forschung und Entwicklung einer Methode für hochreines Kaliumacetat. Journal of Applied Chemistry, 2012, Vol. 85, No.12, pp. 1807-1813. Von link.springer.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.