
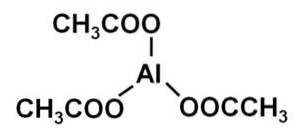
Struktur, Eigenschaften, Verwendungen von Aluminiumacetat (Al (CH3COO) 3)

Das Aluminiumacetat ist eine organische Verbindung, die durch ein Aluminiumion Al gebildet wird3+ und drei Acetationen CH3GURREN-. Seine chemische Formel lautet Al (CH3GURREN)3. Es ist auch als Aluminiumtriacetat bekannt. Es ist ein leicht hygroskopischer weißer Feststoff und wasserlöslich..
Um diese Verbindung zu erhalten, müssen vollständig wasserfreie Bedingungen angewendet werden, dh frei von Wasser, andernfalls das Aluminiumdiacetat Al (OH) (CH3GURREN)zwei.
Aluminiumacetatlösungen haben antibakterielle und antimykotische Eigenschaften, weshalb sie seit dem 19. Jahrhundert zur Behandlung von Infektionen, insbesondere der Ohren, eingesetzt werden..
Am bekanntesten ist Burows Lösung, die von einem deutschen Arzt entwickelt wurde. Die Verwendung hat jedoch gelegentlich zu einer Schädigung des Mittelohrs geführt..
Diese Lösung wurde auch zur Behandlung von Hautproblemen wie Juckreiz und Hautausschlägen verwendet. Es wird sogar als Sonnenbrandmittel verwendet.
Aluminiumacetat und seine Derivate werden verwendet, um sehr kleine Strukturen oder Partikel aus Aluminiumoxid Al zu erhaltenzweiODER3. Diese Strukturen oder Nanopartikel können in Form von Blättern, Blüten oder Nanoröhren vorliegen..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Löslichkeit
- 3.4 Chemische Eigenschaften
- 3.5 Andere Eigenschaften
- 4 Erhalten
- 5 Verwendung in der Medizin
- 5.1 Ohrenentzündungen
- 5.2 Hautkrankheiten
- 6 Andere Verwendungen
- 6.1 Nicht mehr verwendet
- 7 Schädliche Wirkungen
- 8 Referenzen
Struktur
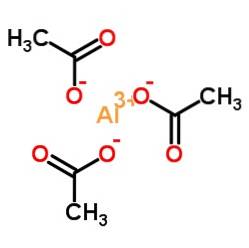
Aluminiumtriacetat besteht aus einem Aluminiumkation Al3+ und drei Acetatanionen CH3GURREN-. Es ist das Aluminiumsalz der Essigsäure CH3COOH.
Aluminium ist über seinen Sauerstoff an Acetatanionen gebunden. Mit anderen Worten, es ist an drei Sauerstoffatome gebunden. Diese Übergänge sind ionisch.
Nomenklatur
- Aluminiumacetat
- Aluminiumtriacetat
- Aluminiumethanoat
- Burows Lösung (Übersetzung aus dem Englischen Burows Lösung): Es ist eine Lösung von Aluminiumacetat.
Eigenschaften
Körperlicher Status
Solides Weiss.
Molekulargewicht
204,11 g / mol
Löslichkeit
In Wasser löslich.
Chemische Eigenschaften
In wässriger Lösung wird Aluminiumtriacetat gelöst und neigt dazu, Diacetat Al (OH) (CH) zu bilden3COO) und manchmal Al (OH) -Monoacetatzwei(CH3GURREN). Es hängt alles vom pH-Wert und der Menge an Essigsäure CH ab3In der Lösung vorhandenes COOH.
Al (CH3GURREN)3 + H.zweiO ⇔ Al (OH) (CH3GURREN)zwei + CH3COOH
Al (CH3GURREN)3 + 2 hzweiO ⇔ Al (OH)zwei(CH3COO) + 2 CH3COOH
Andere Eigenschaften
Aluminiumacetat ist leicht hygroskopisch, dh es neigt dazu, Wasser aus der Luft zu absorbieren.
Erhalten
Aluminiumacetat wird vorzugsweise unter streng wasserfreien Bedingungen erhalten, dh in völliger Abwesenheit von Wasser. Dies schließt auch die Abwesenheit von Luft ein, da diese Feuchtigkeit enthalten kann..
Eine Mischung aus Eisessig CH erhitzen3COOH und Essigsäureanhydrid (CH3CO)zweiOder unter solchen Bedingungen, dass das gesamte vorhandene Wasser entfernt werden kann. Zu dieser heißen Mischung wird Aluminiumchlorid AlCl gegeben.3 wasserfreier Feststoff (ohne Wasser).
Ein weißer Feststoff aus Al (CH3GURREN)3.
AlCl3 + 3 CH3COOH → Al (CH3GURREN)3 + 3 HCl
Die völlige Abwesenheit von Wasser ist wichtig, um die Bildung von Salzen von Aluminiummonoacetat Al (OH) zu vermeiden.zwei(CH3COO) und Aluminiumdiacetat Al (OH) (CH3GURREN)zwei.
Es kann auch durch Reaktion von Aluminiumhydroxid Al (OH) erhalten werden.3 und Essigsäure CH3COOH.
Verwendung in der Medizin
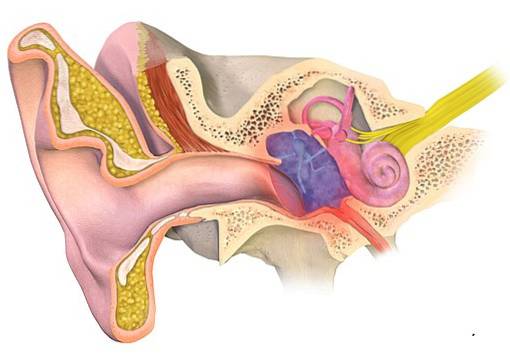
Ohr-Infektion
Aluminiumacetat wird seit dem 19. Jahrhundert zur Behandlung von Otitis verwendet, einer Entzündung des Außen- oder Mittelohrs, die normalerweise mit einer Infektion einhergeht. Seine Verwendung beruht auf seiner antibakteriellen und antimykotischen Wirkung.
Es wurde in Form einer 13% igen Aluminiumacetatlösung verwendet, die ursprünglich vom deutschen Arzt Karl August von Burow entwickelt wurde, weshalb es als Burow-Lösung bezeichnet wird..
Es wurde festgestellt, dass es das Wachstum von Mikroorganismen hemmt, die üblicherweise in Mittelohrentzündungen oder externen Erkrankungen wie Mittelohrentzündungen vorkommen. Pseudomonas aeruginosa, das Staphylococcus aureus und der Proteus mirabilis.

Es gibt jedoch diejenigen, die berichten, dass diese Lösungen für das Ohr schädlich sein können. Einige Tierstudien untersuchen die toxischen Wirkungen auf das Ohr, haben jedoch widersprüchliche Ergebnisse gemeldet..
Einige Forscher empfehlen, kein Aluminiumacetat zu verwenden, wenn das Trommelfell perforiert ist, da beobachtet wurde, dass es eine entzündliche Wirkung auf das Mittelohr ausübt.
Hautkrankheiten
Burows Lösung wird als Antiseptikum, Adstringens und als topische Lösung zur Behandlung von schweren Hautausschlägen, Dermatitis, Entzündungen, Juckreiz, Brennen und Sonnenbrand verwendet. Wirkt beruhigend und irritationsmindernd.
Andere Verwendungen
Aluminiumtriacetat und seine Derivate werden für viele qualitative und quantitative chemische Experimente verwendet.
Ein Derivat von Aluminiumtriacetat, Al (OH) (CH3GURREN)zwei Es wird auch als Aluminiumhydroxidacetat bezeichnet und als Vorstufe verwendet, um Nanostrukturen von Gamma-Aluminiumoxid (γ-Al) zu erhaltenzweiODER3).
Vorläufer bedeutet in diesem Fall, dass die γ-Al-Nanostrukturen aus Aluminiumdiacetat (auf besondere Weise erhalten) hergestellt werden.zweiODER3, und dies wird erreicht, indem es auf sehr hohe Temperaturen erhitzt wird.
Nanostrukturen sind sehr kleine Partikel, die nur mit speziellen Mikroskopen wie Elektronenmikroskopen beobachtet werden können. Mit Aluminiumacetat als Vorstufe wurden γ-Al-Nanostrukturen erhaltenzweiODER3 ähnlich wie Blätter, Blüten, Fasern und sogar Nanoröhren.

Nicht mehr verwendet
Zu Beginn des 20. Jahrhunderts wurde Aluminiumacetat als Konservierungsmittel in Lebensmitteln wie Dosenwürsten verwendet.
Eine Aluminiumacetatlösung wurde durch Mischen von Aluminiumsulfat Al hergestelltzwei(SW4)3, Calciumcarbonat CaCO3, Essigsäure CH3COOH und Wasser H.zweiOder, und es wurde dem Essen hinzugefügt.
Wenn diese Lösung mit dem Fleisch in Kontakt kommt, wird das Aluminium in seinen Bestandteilen in Form einer Verbindung fixiert, die in kochendem Wasser unlöslich ist, sich jedoch in Magensäften zu etwa 80% löst.
Bereits 1904 war bekannt, dass Aluminiumsalze die Verdauung sowohl im Magen als auch im Darm verlangsamen. Daher ist es eine unerwünschte Praxis, Konserven Aluminiumacetatlösungen zuzusetzen..

Schädigende Wirkungen
Da es Studien gibt, die berichten, dass Aluminiumacetat toxisch sein kann, wurden Tests durchgeführt, bei denen Labormäusen Aluminiumacetat injiziert wurde.
Die Ergebnisse zeigen, dass diese Verbindung eine Schädigung der Wirbelsäule der Tiere sowie eine Schädigung der Chromosomen und Spermien der Tiere verursacht. Mit anderen Worten ist es genotoxisch.
Dies weist Sie auf mögliche Gesundheitsrisiken hin, die durch eine übermäßige Exposition gegenüber Aluminiumacetat verursacht werden können, und auf die Vorsicht, die bei der Verwendung angewendet werden sollte..
Verweise
- Mac-Kay Chace, E. (1904). Die Verwendung von basischem Aluminiumacetat als Konservierungsmittel in Wurst. Journal of the American Chemical Society 1904, 26, 6: 662 & ndash; 665. Von pubs.acs.org wiederhergestellt.
- Hood, G.C. und Ihde, A.J. (1950). Aluminiumacetate und -propionate - ihre Herstellung und Zusammensetzung. Journal of the American Chemical Society 1950, 72, 5: 2094 & ndash; 2095. Von pubs.acs.org wiederhergestellt.
- Pitaro, J. et al. (2013). Ototoxizität von Aluminiumacetat / Benzolethoniumchlorid-Otic-Lösung im Chinchilla-Tiermodell. Laryngoskop, 2013; 123 (10): 2521 & ndash; 5. Von ncbi.nlm.nih.gov wiederhergestellt.
- Thorp, M.A. et al. (2000). Burow-Lösung bei der Behandlung der aktiven suppurativen Mittelohrentzündung der aktiven Schleimhaut: Bestimmung einer wirksamen Verdünnung. The Journal of Laryngology & Otology, Juni 2000, Bd. 114, S. 432-436. Von ncbi.nlm.nih.gov wiederhergestellt.
- D'Souza, Herr P. et al. (2014). Bewertung der Genotoxizität von Aluminiumacetat in Knochenmark, männlichen Keimzellen und fötalen Leberzellen von Schweizer Albinomäusen. Mutation Research 766 (2014) 16-22. Von ncbi.nlm.nih.gov wiederhergestellt.
- Y. Basal et al. (2015). Die Auswirkungen topischer Burow- und Castellani-Lösungen auf die Mittelohrschleimhaut von Ratten. J. Int Adv Otol 2015; 11 (3): 253-6. Von advancedotology.org wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Aluminiumacetat. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Buttaravoli, P. und Leffler, S.M. (2012). Sonnenbrand. Was zu tun ist. In kleinen Notfällen (dritte Ausgabe). Von sciencedirect.com wiederhergestellt.
- Thompson, E. und Kalus, A. (2017). Akute Hautreaktionen und bakterielle Infektionen. Behandlung. Im Reise- und Tropenmedizin-Handbuch (5. Auflage). Von sciencedirect.com wiederhergestellt.
- Kim, T. et al. (2010). Morphologisch kontrollierbare Synthese von Gamma-Aluminiumoxid-Nanostrukturen über eine ionische flüssigkeitsunterstützte hydrothermale Route. Crystal Growth & Design, Bd. 10, Nr. 7, 2010, S. 2928-2933. Von pubs.acs.org wiederhergestellt.
- Rajala, J.W. et al. (2015). Elektrogesponnene Core-Shell-Hohlaluminiumoxid-Keramikfasern. Fibers 2015, 3, 450 & ndash; 462. Von mdpi.com wiederhergestellt.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.