
50 Beispiele für Säuren und Basen

Es gibt hunderte Beispiele für Säuren und Basen Das gibt es in allen Bereichen der Chemie, aber insgesamt sind sie in zwei große Familien unterteilt: anorganische und organische. Anorganische Säuren werden üblicherweise als Mineralsäuren bezeichnet, die sich durch besondere Stärke im Vergleich zu organischen Säuren auszeichnen..
Unter Säuren und Basen werden Substanzen verstanden, die saure bzw. saftige Aromen haben. Beide sind ätzend, obwohl das Wort "ätzend" häufig für starke Basen verwendet wird. Fazit: Sie verbrennen und korrodieren die Haut, wenn sie berührt werden. Seine Eigenschaften beim Auflösen von Medien haben eine Reihe von Definitionen im Laufe der Geschichte geleitet..
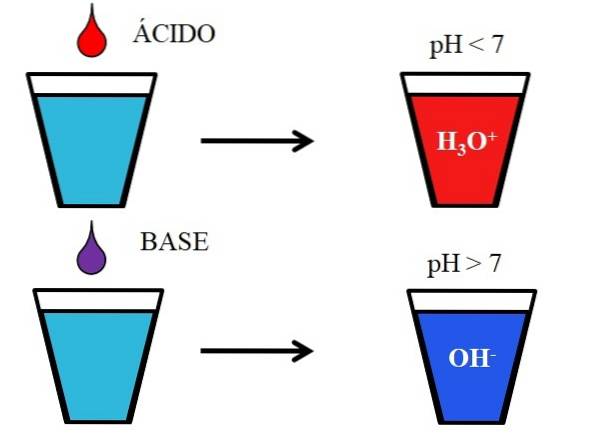
Das Bild unten zeigt das generische Verhalten von Säuren und Basen, wenn sie in einem Glas Wasser hinzugefügt oder gelöst werden. Säuren erzeugen aufgrund von Hydroniumionen, H, Lösungen mit pH-Werten unter 73ODER+;; während die Basen aufgrund der Hydroxyl- (oder Hydroxyl-) Ionen, OH, Lösungen mit einem pH-Wert über 7 produzieren-.
Wenn wir dem Glas Salzsäure, HCl (roter Tropfen), hinzufügen, entstehen H-Ionen3ODER+ und Cl- hydratisiert. Wenn wir dagegen das Experiment mit Natriumhydroxid, NaOH (lila Tropfen), wiederholen, haben wir OH-Ionen- und Na+.
Artikelverzeichnis
- 1. Definitionen
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Beispiele für Säuren
- 3 Beispiele für Basen
- 4 Referenzen
Definitionen

Die zunehmend untersuchten und verstandenen Eigenschaften von Säuren und Basen begründeten mehr als eine Definition für diese chemischen Verbindungen. Unter diesen Definitionen haben wir Arrhenius, Bronsted-Lowry und schließlich Lewis. Bevor Sie die Beispiele zitieren, müssen Sie sich darüber im Klaren sein.
Arrhenius
Säuren und Basen sind nach Arrhenius solche, die, wenn sie in Wasser gelöst werden, H-Ionen produzieren3ODER+ oder OH-, beziehungsweise. Das heißt, das Bild repräsentiert bereits diese Definition. An sich vernachlässigt es jedoch einige Säuren oder Basen, die zu schwach sind, um solche Ionen zu produzieren. Hier kommt die Bronsted-Lowry-Definition ins Spiel..
Bronsted-Lowry
Brönsted-Lowry-Säuren sind solche, die H-Ionen abgeben können+, und die Basen sind diejenigen, die diese H akzeptieren+. Wenn eine Säure sehr leicht ihr H spendet+, bedeutet, dass es eine starke Säure ist. Das gleiche passiert mit den Basen, aber das Akzeptieren von H.+.
Wir haben also starke oder schwache Säuren und Basen, und ihre Kräfte werden in verschiedenen Lösungsmitteln gemessen; insbesondere in Wasser, aus dem die bekannten pH-Einheiten ermittelt werden (von 0 bis 14).
Daher spendet eine stark saure HA Ihr H vollständig+ zu Wasser in einer Reaktion des Typs:
HA + H.zweiO => A.- + H.3ODER+
Wohin- ist die konjugierte Base von HA. Daher kommt das H.3ODER+ im Glas mit saurer Lösung vorhanden.
Währenddessen deprotoniert eine schwache Base B das Wasser, um sein jeweiliges H zu erhalten+::
B + H.zweiODER <=> HB + OH-
Wobei HB die konjugierte Säure von B ist. Dies ist der Fall bei Ammoniak, NH3::
NH3 + H.zweiODER <=> NH4+ + Oh-
Eine sehr starke Base kann direkt OH-Ionen abgeben- ohne mit Wasser reagieren zu müssen; genau wie NaOH.
Lewis
Schließlich sind Lewis-Säuren diejenigen, die Elektronen gewinnen oder annehmen, und Lewis-Basen sind diejenigen, die Elektronen abgeben oder verlieren..
Zum Beispiel die Bronsted-Lowry NH-Base3 Es ist auch eine Lewis-Base, da das Stickstoffatom ein H akzeptiert+ indem er sein Paar freier Elektronen spendet (H.3N: H.+). Aus diesem Grund stimmen die drei Definitionen nicht überein, sondern verflechten sich und helfen, den Säuregehalt und die Basizität in einem breiteren Spektrum chemischer Verbindungen zu untersuchen..
Beispiele für Säuren
Nach Klärung der Definitionen wird nachfolgend eine Reihe von Säuren mit ihren jeweiligen Formeln und Namen erwähnt:
-HF: Flusssäure
-HBr: Bromwasserstoffsäure
-HI: Iodwasserstoffsäure
-H.zweiS: Schwefelwasserstoff
-H.zweiSe: Selensäure
-H.zweiTee: Tellursäure
Dies sind die binären Säuren, auch Hydracide genannt, zu denen die vorgenannte Salzsäure HCl gehört.
-HNO3: Salpetersäure
-HNOzwei: Salpetersäure
-HNO: hyponitrische Säure
-H.zweiCO3: Kohlensäure
-H.zweiCOzwei: kohlenstoffhaltige Säure, die eigentlich besser unter dem Namen Ameisensäure bekannt ist, HCOOH, die einfachste organische Säure von allen
-H.3PO4: Phosphorsäure
-H.3PO3 oder H.zwei[HPO3]: Phosphorsäure mit einer H-P-Bindung
-H.3POzwei oder H [H.zweiPOzwei]: Hypophosphorsäure mit zwei H-P-Bindungen
-H.zweiSW4: Schwefelsäure
-H.zweiSW3: schweflige Säure
-H.zweiS.zweiODER7: Schwefelsäure
-HIO4: Periodsäure
-HIO3: Jodsäure
-HIOzwei: Jodsäure
-HIO: Hypoiodinsäure
-H.zweiCrO4: Chromsäure
-HMnO4: Mangansäure
-CH3COOH: Essigsäure (Essig)
-CH3SW3H: Methansulfonsäure
Alle diese Säuren mit Ausnahme von Ameisensäure und den letzten beiden sind als Oxaciden oder ternäre Säuren bekannt..
Andere:
-AlCl3: Aluminiumchlorid
-FeCl3: Eisenchlorid
-BF3: Bortrifluorid
-In Wasser gelöste Metallkationen
-Carbokationen
-H (CHBelfClelf): Supersäure Carboran
- BFS3H: Fluorsulfonsäure
- HSbF6: Fluorantimonsäure
- BFS3H SbF5: magische Säure
Die letzten vier Beispiele bilden die furchterregenden Supersäuren; Verbindungen, die in der Lage sind, fast jedes Material durch Berühren zu zersetzen. AlCl3 ist ein Beispiel für Lewis-Säure, da das Metallzentrum von Aluminium aufgrund seines elektronischen Mangels Elektronen aufnehmen kann (es vervollständigt sein Valenzoktett nicht)..
Beispiele für Basen
Unter den anorganischen Basen befinden sich Metallhydroxide wie Natriumhydroxid und einige molekulare Hydride wie bereits erwähntes Ammoniak. Hier sind andere Beispiele für Basen:
-KOH: Kaliumhydroxid
-LiOH: Lithiumhydroxid
-RbOH: Rubidiumhydroxid
-CsOH: Cäsiumhydroxid
-FrOH: Franciumhydroxid
-Sei (OH)zwei: Berylliumhydroxid
-Mg (OH)zwei: Magnesiumhydroxid
-Ca (OH)zwei: Kalziumhydroxid
-Sr (OH)zwei: Strontiumhydroxid
-Ba (OH)zwei: Bariumhydroxid
-Ra (OH)zwei: Radiumhydroxid
-Fe (OH)zwei: Eisenhydroxid
-Fe (OH)3: Eisenhydroxid
-Al (OH)3: Aluminiumhydroxid
-Pb (OH)4: Bleihydroxid
-Zn (OH)zwei: Zinkhydroxid
-Cd (OH)zwei: Cadmiumhydroxid
-Cu (OH)zwei: Kupferhydroxid
-Ti (OH)4: Titanhydroxid
-PH3: Phosphin
-Asche3: Arsin
-NaNHzwei: Natriumamid
- C.5H.5N: Pyridin
-(CH3) N: Trimethylamin
- C.6H.5NHzwei: Phenylamin oder Anilin
-NaH: Natriumhydrid
-KH: Kaliumhydrid
-Carbanionen
-Li3N: Lithiumnitrid
-Alkoxide
-[(CH3)zweiCH]zweiNLi: Lithiumdiisopropylamid
-Diethynylbenzolanion: C.6H.4C.4zwei- (die stärkste bisher bekannte Basis)
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Naomi Hennah. (10. Oktober 2018). Wie man Säuren, Basen und Salze lehrt. Wiederhergestellt von: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31. August 2019). Formeln gemeinsamer Säuren und Basen. Wiederhergestellt von :oughtco.com
- David Wood. (2019). Vergleich von gängigen Säuren und Basen. Studie. Wiederhergestellt von: study.com
- Ross Pomeroy. (23. August 2013). Die stärksten Säuren der Welt: Wie Feuer und Eis. Wiederhergestellt von: realclearscience.com
- Wikipedia. (2019). Diethynylbenzoldianion. Wiederhergestellt von: en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.