
30 Chemische Reaktionen des Alltags
Das chemische Reaktionen wir können sie im Alltag allgemein finden. Dies ist die Antwort, die ein Chemiker Ihnen ohne Fehler geben könnte, um zu übertreiben. Wenn beispielsweise ein Streichholz brennt, tritt eine Verbrennungsreaktion auf.
Und es ist so, dass jemand, der in dieser Angelegenheit eifrig ist, versucht, Dinge aus molekularer oder atomarer Sicht zu sehen, überall Reaktionen zu sehen und Moleküle ständig umzuwandeln.

Menschen, die sich mit Chemie auskennen, können nicht anders, als die Dinge unter diesem Gesichtspunkt zu sehen, so wie ein Physiker die Dinge aus nuklearer Sicht oder ein Biologe aus zellulärer Sicht sehen könnte..
Um den Kommentar zu rechtfertigen, hier 30 Beispiele für Chemie im Alltag. Es sind chemische Reaktionen, die zu Hause, in der Küche, im Garten, auf der Straße oder sogar in unserem eigenen Körper unbemerkt bleiben. Ich hoffe, damit die übliche und routinemäßige Chemie des Alltags zu beleuchten.
Chemische Reaktionen, die Sie jeden Tag in Ihrem Leben sehen
Chemie in der Küche
1- Lösungsreaktionen: Wenn Salz in Wasser gelöst wird, werden Ionenbindungen aufgebrochen, wodurch Kationen und Anionen solvatisiert werden.
NaCl → Na+ + Cl-
Technisch wird eine Lösung von Natriumchlorid in Wasser hergestellt.
2- Phasenwechsel: Wenn beim Kochen oder Zubereiten von Kaffee oder Tee Wasser gekocht wird, tritt ein Phasenwechsel zwischen flüssigem Wasser und kohlensäurehaltigem Wasser auf.
H.zweiODER(l) → H.zweiODER(G)
3- Verbrennungsreaktionen- Gasherde verwenden Propan, um eine Flamme zu erzeugen.
C.3H.8 + 50zwei → 3COzwei + 4HzweiODER
4- Chlor: Das als Waschmittel verwendete Chlor ist tatsächlich Natriumchlorit, das ein Reduktionsmittel ist. Flecken auf der Kleidung werden Chromophore genannt und sind ungesättigt. Chlor greift diese Ungesättigtheiten an, indem es die Farbe von den Flecken entfernt. Technisch entfernt es den Fleck nicht, macht ihn aber unsichtbar.
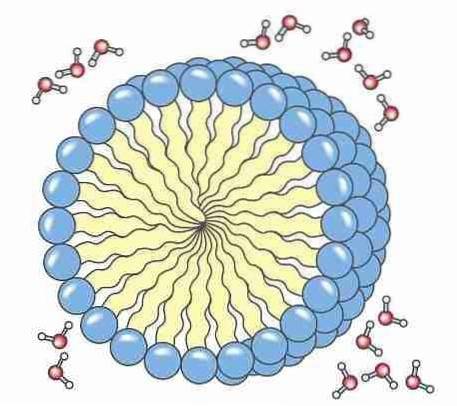
5- Die Seife: Seifen und Detergenzien haben einen polaren Teil, üblicherweise eine Carbonsäure, der an eine unpolare aliphatische Kette gebunden ist, wodurch sie die Fähigkeit zur Bildung von Mizellen erhalten. Diese Mizellen können Schmutz umgeben, so dass er von Kleidung, Geschirr und unserem Körper entfernt werden kann..
6- Backpulver: Es ist eine schwache Base, die bei der Reaktion mit Säure wie Essig oder Wasser (das leicht sauer ist) Kohlendioxid freisetzt.
NaHCO3 + CH3COOH → CH3COONa + H.zweiO + COzwei
Diese Verbindung ist der Wirkstoff in vielen Antazida..
7- MittelfristigKochen ist eine chemische Veränderung, die Lebensmittel verändert, um sie schmackhafter zu machen, gefährliche Mikroorganismen abzutöten und sie leichter verdaulich zu machen.
Die Hitze des Kochens kann Proteine denaturieren, chemische Reaktionen zwischen Zutaten fördern, Zucker karamellisieren usw..
8- Künstlicher Geschmack und Farbe: Viele verarbeitete Lebensmittel enthalten Chemikalien, die ihnen einen bestimmten Geschmack oder eine bestimmte Farbe verleihen und zur Konservierung beitragen.
9- Weinen Sie nach der Zwiebel: Zwiebel enthält Moleküle von Aminosäuresulfoxiden. Wenn die Zwiebel geschnitten wird, werden die Zellwände aufgebrochen, wobei diese Sulfoxide zusammen mit Enzymen freigesetzt werden, die sie in Sulfensäuren zerlegen, eine Organoschwefelverbindung mit der Formel R-SOH, die die Augen reizt..
Chemie zu Hause
10- Batterien: Sie verwenden elektrodochemische oder Redoxreaktionen, um chemische Energie in elektrische Energie umzuwandeln. In galvanischen Zellen treten spontane Redoxreaktionen auf, während in elektrolytischen Zellen nicht spontane chemische Reaktionen stattfinden..
11- LCD-Bildschirme: LCD-Fernseher enthalten helikale Kristallmoleküle, die die Eigenschaft haben, sich an einem elektrischen Signal zu orientieren und den Ton oder die Farbe einer LED-Lampe zu ändern. Jedes Kristallmolekül repräsentiert ein Pixel auf dem Fernseher. Je mehr Moleküle, desto höher die Auflösung..
12- Alte Bücher, die gut riechen: Die Zersetzung der Zellulose des Papiers der Bücher verleiht den Blättern diese gelbliche Farbe und einen Geruch nach Vanille. Wenn Sie alte Bücher in Ihrer Bibliothek haben, die gut riechen, liegt dies an Lignin- oder Vanillinmolekülen..
13- Medikamente und Drogen: Einige Medikamente sind Moleküle, die die durch einen bestimmten Reiz hervorgerufene hormonelle Aktivität teilweise blockieren (z. B. Antiepileptika), während andere Enzyminhibitoren sind, wie z. B. Schmerzmittel.

14- Shampoo: Wie Waschmittel und Seifen entfernen Shampoos Öl von der Kopfhaut, indem sie Mizellen bilden. Der Bestandteil, der sich darum kümmert, sind üblicherweise Sulfate wie Natrium- oder Ammoniumdodecylsulfat oder Laurylethersulfat..
15- Deodorants und Antitranspirantien: Der schlechte Geruch der Achselhöhlen, Füße und des Atems wird von Bakterien erzeugt, die sich von den Proteinen und Fetten im Schweiß ernähren, die von den apokrinen Drüsen ausgeschieden werden.
Deodorants haben eine chemische Verbindung namens Triclosan, die ein starkes antibakterielles und fungizides Mittel ist. Andererseits haben Antitranspirantien Aluminiumsalze, die in die Poren gelangen und das Schwitzen verhindern..
16- Kosmetik und Make-up: sind Chemikalien und Pigmente, die auf der Haut haften. Sie sind normalerweise unpolare Verbindungen wie Wachse und Öle.
Chemie im Garten
17- Photosynthese: ist der Prozess, mit dem grüne Pflanzen ihre eigene Nahrung herstellen. Dies geschieht in Gegenwart von Sonnenlicht und anderen Rohstoffen, nämlich Kohlendioxid und Wasser. Chlorophyllpigment sammelt Lichtenergie aus Sonnenlicht, das in Glukose umgewandelt wird.
6COzwei+ 6HzweiO + hν → C.6H.12ODER6 + 6 ..zwei
18- Oxidationsreaktionen- Auf unlackierten Eisenoberflächen wird häufig eine Rostbeschichtung festgestellt, die allmählich zum Zerfall des Eisens führt. Dies ist ein chemisches Phänomen, das als Oxidation bezeichnet wird..
In diesem Fall verbindet sich Eisen in Gegenwart von Wasser mit Sauerstoff, was zur Bildung von Eisenoxiden führt..
Glaube + O.zwei + H.zweiO → GlaubezweiODER3. XHzweiODER
19- organische Zersetzung: Die Zersetzung von Bio-Lebensmitteln oder sogar Lebewesen sind Oxidationsreaktionen von Bakterien, die biochemische Makromoleküle in einfache Moleküle wie Nitrite, Nitrate, CO abbauenzwei und Wasser.

20- Düngemittel: Kalium, Nitrate, Phosphate und Sulfate werden in Böden verwendet, um Pflanzen mit Nährstoffen zu versorgen und sie können wachsen.
21- Pestizide: Es handelt sich um Chemikalien, die zur Begasung von Pflanzen oder Gärten verwendet werden. Es handelt sich normalerweise um Neurotoxine, die Bakterien oder Insekten befallen, die Pflanzen konsumieren.
Chemie auf der Straße
22- Verbrennung von Benzin: Autos verwenden Benzin als Kraftstoff durch kontrollierte Explosionen, die die Kolben der Motoren bewegen.
23- Rauch aus Autos: produziert freie Radikale, die sehr reaktive Verbindungen sind und die Haut oder Haare angreifen, wodurch sie trocken und spröde werden, ganz zu schweigen davon, dass sie krebserregend sind.
24- Saurer Regen: Der Überschuss an Schwefel und Stickoxiden in der Atmosphäre, der von Fabriken und Automobilen erzeugt wird, löst sich im Wasser der Wolken auf und erzeugt Schwefel-, Schwefel- und Salpetersäure, die in Form von saurem Regen ausfällt.

25- Konstruktionen: Zement und andere Materialien, die beim Bau von Häusern verwendet werden, wie Farben, Gips und viele andere, sind Produkte der Chemie. Insbesondere besteht Zement aus Calciumhydroxidmolekülen, auch Branntkalk genannt..
Chemie in Ihrem Körper
26- Nahrungsverdauung- Die Verdauung beruht auf chemischen Reaktionen zwischen Nahrungsmitteln, Säuren und Enzymen, um Moleküle in Nährstoffe zu zerlegen, die der Körper aufnehmen und verwenden kann.
27- Aerobe Atmung: Der Hauptprozess, der im Körper Energie erzeugt, ist die aerobe Glykolyse. Hier hilft die Atmung dabei, Glukose (eine Energiequelle) in Form von ATP in Wasser, Kohlendioxid und Energie zu zerlegen. C.6H.12ODER6 + 6 ..zwei → 6COzwei + 6HzweiO + Energie (36 ATPs)
28- Anaerobe Atmung: Aufgrund von Überanstrengung geht unseren Körperzellen manchmal der Sauerstoff aus und sie atmen anaerob. Dies bewirkt die Synthese von Milchsäure. Anaerobe Atmung wird bei einigen Bakterien, Hefen und anderen Organismen beobachtet. Die anaerobe Atmungsgleichung lautet:
C.6H.12ODER6 → 2C3H.6ODER3 + Energie (2ATP)
29- Muskelbewegung: Die Spannung oder Entspannung der Muskeln ist auf die Konformationsänderungen der Proteine des Skelettmuskels zurückzuführen. Diese Veränderungen entstehen durch Phosphokreatin, das durch den Verlust eines Phosphats Energie für den Prozess freisetzt.

30- Gedanke: Es ist ein komplexer biochemischer Prozess, bei dem die Ionenpotentialdifferenz die elektrischen Impulse der Neuronen erzeugt.
Verweise
- Ali, A. (2013, 20. April). chemische Reaktion in unserem täglichen Leben. Von meritnation wiederhergestellt: meritnation.com.
- , G. (2015, 27. Dezember). Was sind einige Beispiele für chemische Reaktionen im Alltag? Von socratic.org wiederhergestellt.
- Chemische Reaktionen im Alltag. (2016, 3. August). Von summle.com wiederhergestellt.
- Crystal, M. (2017, 25. April). Wie werden Oxidations-Reduktions-Reaktionen im Alltag eingesetzt?? Von sciencing.com wiederhergestellt.
- Helmenstine, A. (2015, 15. August). Was sind einige Beispiele für Chemie im täglichen Leben?? Von sciencenotes.org wiederhergestellt.
- Helmenstine, A. M. (2017, 28. März). 10 Beispiele für chemische Reaktionen im Alltag. Von gedankenco.com wiederhergestellt.
- Helmenstine, A. M. (2017, 29. März). Beispiele für chemische Veränderungen. Von gedankenco.com wiederhergestellt.
- Reaktionen. (2016, 7. Juni). Warum bringen Zwiebeln dich zum Weinen?? . Von youtube.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.