
Perchloroxid (Cl2O7) Formel, Eigenschaften, Risiken

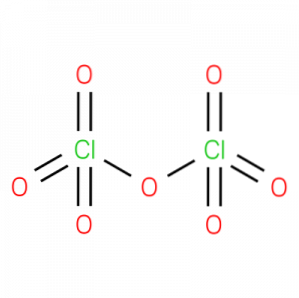
Das Perchloroxid, auch Chlor (VII) -oxid, Perchlorsäureanhydrid oder Dichlorheptoxid genannt,ist eine anorganische chemische Verbindung mit der Formel ClzweiO7. Seine Struktur ist in Abbildung 1 dargestellt.
Es ist eines der stabilsten Chloroxide und reagiert mit Wasser unter Bildung von Perchlorsäure: ClzweiODER7 + H.zweiO D 2HClO4.
Die Verbindung wird durch vorsichtige Dehydratisierung von Perchlorsäure mit Phosphorpentoxid bei -10ºC erhalten.
2HClO4 + P.zweiODER5 ClzweiODER7 + 2HPO3
Die Verbindung wird destilliert, um sie mit großer Vorsicht von Metaphosphorsäure zu trennen, da sie explosiv ist. Es kann auch durch Anzünden von Gemischen aus Chlor und Ozon gebildet werden.
Physikalische und chemische Eigenschaften von Perchloroxid
Chloroxid (VII) ist eine farblose, flüchtige und ölige Flüssigkeit. Sein Molekulargewicht beträgt 182,9 g / mol, seine Dichte beträgt 1900 kg / m3 und seine Schmelz- und Siedepunkte betragen -91,57 ºC bzw. 82 ºC..
Es ist beim Aufprall oder bei Kontakt mit der Flamme und insbesondere in Gegenwart seiner Zersetzungsprodukte spontan explosiv..
Chlorheptoxid löst sich bei Raumtemperatur in Tetrachlorkohlenstoff und reagiert mit Wasser unter Bildung von Perchlorsäure. Bursts bei Kontakt mit Jod.
Unter normalen Bedingungen ist es stabiler, wenn auch mit weniger Oxidationskraft als die anderen Chloroxide. Zum Beispiel greift es Schwefel, Phosphor oder Papier nicht an, wenn es kalt ist.
Dichlorheptoxid ist ein stark saures Oxid und bildet in Lösung ein Gleichgewicht mit Perchlorsäure. Bildet Perchlorate in Gegenwart von Alkalimetallhydroxiden.
Seine thermische Zersetzung wird durch die monomolekulare Dissoziation von Chlortrioxid und Radikalen erzeugt
Reaktivität und Gefahren
Perchloroxid ist eine instabile Verbindung. Zersetzt sich bei Lagerung langsam, wobei farbige Zersetzungsprodukte entstehen, die niedere Chloroxide sind.
Es ist spontan explosiv, insbesondere in Gegenwart seiner Zersetzungsprodukte, unverträglich mit Reduktionsmitteln, starken Säuren und Basen..
Obwohl es das stabilste Chloroxid ist, ist ClzweiODER7 Es ist ein starkes Oxidationsmittel sowie ein Sprengstoff, der durch Flamme, mechanischen Schlag oder durch Kontakt mit Jod gelöscht werden kann..
Es ist jedoch weniger oxidierend als die anderen Chloroxide und greift Schwefel, Phosphor oder Papier im kalten Zustand nicht an. Hat die gleichen Auswirkungen auf den menschlichen Körper wie elementares Chlor und erfordert die gleichen Vorsichtsmaßnahmen
Verschlucken verursacht schwere Verbrennungen an Mund, Speiseröhre und Magen. Dampf ist beim Einatmen sehr giftig.
Überprüfen Sie bei Kontakt mit den Augen, ob Sie Kontaktlinsen tragen, und entfernen Sie diese sofort. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten. Kaltes Wasser kann verwendet werden. Augensalbe sollte nicht verwendet werden.
Wenn die Chemikalie mit Kleidung in Kontakt kommt, entfernen Sie sie so schnell wie möglich, um Ihre eigenen Hände und Ihren Körper zu schützen. Stellen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie auf der exponierten Haut des Opfers ansammelt, z. B. auf den Händen, wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen..
Kaltes Wasser kann verwendet werden. Bei anhaltender Reizung einen Arzt aufsuchen. Waschen Sie die kontaminierte Kleidung, bevor Sie sie erneut verwenden.
Im Falle einer Inhalation sollte das Opfer in einem gut belüfteten Bereich ruhen dürfen. Wenn die Inhalation schwerwiegend ist, sollte das Opfer so bald wie möglich an einen sicheren Ort evakuiert werden..
Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte. Wenn das Opfer Schwierigkeiten beim Atmen hat, sollte Sauerstoff verabreicht werden.
Wenn das Opfer nicht atmet, wird eine Mund-zu-Mund-Beatmung durchgeführt. Denken Sie immer daran, dass es für die Person, die Hilfe leistet, gefährlich sein kann, eine Mund-zu-Mund-Beatmung durchzuführen, wenn das eingeatmete Material giftig, infektiös oder ätzend ist..
Suchen Sie in jedem Fall sofort einen Arzt auf.
Anwendungen
Perchloroxid hat keine praktischen Anwendungen. Es könnte als Oxidationsmittel oder zur Herstellung von Perchlorsäure verwendet werden, aber seine explosive Natur macht es schwierig zu handhaben.
Dichlorheptoxid kann als Reagenz zur Herstellung von Perchloraten oder für die Untersuchung mit verschiedenen Reaktionen verwendet werden.
In der Arbeit von Kurt Baum erhalten die Reaktionen von Perchloroxid mit Olefinen (Baum, 1976), Alkoholen (Kurt Baum, Reaktionen von Dichlorheptoxid mit Alkoholen, 1974), Alkyliodiden und Acylperchlorat mit Ester (Kurt Baum, 1975) Halogenierungen und Oxidationen.
Bei Alkoholen entstehen Alkylperchlorate durch Reaktion mit einfachen Alkoholen wie Ethylenglykol, 1,4-Butadienol, 2,2,2-Trifluorethanol, 2,2-Dinitropropanol. Reagiert mit 2-Propanol zu Isopropylperchlorat. 2-Hexanol und 3-Hexanol ergeben nicht adressierte Perchlorate und ihre jeweiligen Ketone.
Propen reagiert mit Dichlorheptosid in Tetrachlorkohlenstoff unter Bildung von Isopropylperchlorat (32%) und 1-Chlor-2-propylperchlorat (17%). Die Verbindung reagiert mit cis-Buten zu 3-Chlorbutylperchlorat (30%) und 3-Keto-2-butylperchlorat (7%).
Dichlorheptoxid reagiert mit primären und sekundären Aminen in Tetrachlorkohlenstofflösung zu N-Perchloraten:
2 RNH2 + Cl2O7 → 2 RNHClO3 + H2O
2 R2NH + Cl2O7 → 2 R2NClO3 + H2O
Es reagiert auch mit Alkenen zu Alkylperchloraten. Beispielsweise reagiert es mit Propen in Tetrachlorkohlenstofflösung unter Bildung von Isopropylperchlorat und 1-Chlor-2-propylperchlorat (Beard & Baum, 1974)..
Verweise
- Baum, K. (1976). Reaktionen von Dichlorheptoxid mit Olefinen. Org. Chem. 41 (9) , 1663-1665.
- Beard, C. D. & Baum, K. (1974). Reaktionen von Dichlorheptoxid mit Aminen. Zeitschrift der American Chemical Society. 96 (10), 3237-3239.
- Egon Wiberg, N. W. (2001). Anorganische Chemie. Akademische Presse: London.
- EMBL-EBI. (2009, 25. April). Dichlorheptaoxid. Von ChEBI abgerufen: ebi.ac.uk..
- Kurt Baum, C. D. (1974). Reaktionen von Dichlorheptoxid mit Alkoholen. Am. Chem. Soc., 96 (10), 3233-3237.
- Kurt Baum, C. D. (1975). Reaktionen von Dichlorheptoxid und Acylperchloraten mit Ethern. Org. Chem., 40 (1) , 81-85.
- Kurt Baum, C. D. (1975). Reaktionen von Dichlorheptoxid und von Hypohalogeniten mit Alkyliodiden. Org. Chem., 40 (17), 2536-2537.
- Royal Society of Chemistry. (2015). Dichlorheptoxid. Von chemspider abgerufen: chemspider.com.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.