
Chrom (III) oxidstruktur, Nomenklatur, Eigenschaften, Verwendungen
Das Chrom (III) oxid Chromoxid ist ein grüner anorganischer Feststoff, der durch Verbrennen von Chrommetall (Cr) in Sauerstoff (O) gebildet wirdzwei), wobei das Chrom eine Oxidationsstufe von 3+ aufweist. Seine chemische Formel lautet CrzweiODER3. In der Natur kommt es im Mineral Eskolaíta vor. Es sind keine verwendbaren natürlichen Ablagerungen von Chrom (III) oxid bekannt.
Es kann unter anderem durch Erhitzen von Cr hergestellt werdenzweiODER3 hydratisiert (CrzweiODER3.nHzweiO) um das Wasser vollständig zu entfernen. Es wird auch als Produkt der Kalzinierung von Chrom (VI) oxid (CrO) erhalten3).

Der beste Weg, um es rein zu erhalten, ist jedoch die Zersetzung von Ammoniumdichromat (NH)4)zweiCrzweiODER7 bei 200 ° C. Industriell wird es durch Reduktion von Natriumdichromat (Na) hergestelltzweiCrzweiODER7) fest mit Schwefel.
Wenn es fein geteilt ist, hat es eine hellgrüne Farbe mit einem gelblichen Schimmer. Wenn die Partikel jedoch größer sind, zeigt sie eine bläuliche Färbung. Chromoxid ist das stabilste bekannte grüne Pigment. Seine thermische und chemische Beständigkeit macht es zu einem wertvollen keramischen Farbstoff.
Es wird unter anderem in Industrielacken, Lacken, in der Bauindustrie, in Schmuck, als Farbstoff in Kosmetika oder in pharmazeutischen Produkten verwendet..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Mohs Härte
- 3.3 Molekulargewicht
- 3.4 Schmelzpunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 3.8 Brechungsindex
- 3.9 Andere Eigenschaften
- 4 Verwendungen
- 4.1 In der Keramik- und Glasindustrie
- 4.2 In Industrielacken
- 4.3 In der Feuerfestindustrie
- 4.4 Im Bau
- 4.5 Als Pigment in verschiedenen Anwendungen
- 4.6 In Schmuck
- 4.7 Bei der Katalyse chemischer Reaktionen
- 4.8 Bei der Herstellung von Chrom
- 4.9 Auf magnetischen Materialien
- 4.10 Neueste Innovationen
- 5 Referenzen
Struktur
Α-Cr-OxidzweiODER3 Es hat die Korundstruktur. Sein Kristallsystem ist hexagonal rhomboedrisch. Es ist isomorph mit α-Aluminiumoxid und α-FezweiODER3.
Eskolaite, ein natürliches Mineral aus Chrom (III) -oxid, hat die folgende Struktur:
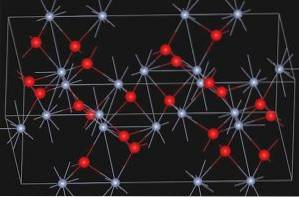
Nomenklatur
- Chrom (III) oxid.
- Chromoxidgrün.
- Dichromtrioxid.
- Chromsesquioxid.
- Chromia.
- Eskolaíta: Chrom (III) -oxidmineral.
- Hydrat: CrzweiODER3.nHzweiO (wobei n ≅ 2 ist) heißt Chrom (III) oxidhydrat oder Guignet Green.

Eigenschaften
Körperlicher Status
Kristalliner Feststoff.
Mohs Härte
9 (seine Kristalle sind extrem hart).
Molekulargewicht
151,99 g / mol.
Schmelzpunkt
Es schmilzt bei 2435 ° C, beginnt jedoch bei 2000 ° C zu verdampfen und bildet grüne Rauchwolken..
Dichte
5,22 g / cm3
Löslichkeit
Wenn es auf hohe Temperaturen erhitzt wurde, ist es in Wasser praktisch unlöslich (3 Mikrogramm / l bei 20 ° C); unlöslich in Alkoholen und Aceton; schwer löslich in Säuren und Laugen; sLöslich in Perchlorsäure (HClO4) auf 70%, in denen es sich zersetzt.
pH
6.
Brechungsindex
2,551.
Andere Eigenschaften
- Wenn es stark kalziniert ist, wird es gegenüber Säuren und Basen inert. Ansonsten ist die CrzweiODER3 und seine hydratisierte Form CrzweiODER3.nHzweiOder sie sind amphoter und lösen sich leicht in Säure unter Bildung von Aquaionen [Cr (H.zweiODER)6]]3+, und in konzentriertem Alkali, um "Chromite" zu bilden..
- Wenn es kalziniert ist, ist es chemisch beständig gegen Säuren, Laugen und hohe Temperaturen. Es ist extrem stabil gegen SOzwei.
- Es hat eine hervorragende Lichtbeständigkeit aufgrund der Tatsache, dass seine Kristalle Opazität, hohe UV-Dämpfung und Transparenz für sichtbares Licht aufweisen..
- Es ist ein extrem hartes Material, es kann Quarz, Topas und Zirkonium zerkratzen.
- Sein Hydrat CrzweiODER3.nHzweiO (wobei n ≅ 2 ist) hat keine thermische Stabilität, sein Hydratationswasser begrenzt seine Anwendbarkeit auf weniger als 260 ºC. Geringe Färbbarkeit und begrenzte Farbpalette.
- Aber dieses Hydrat hat einen sehr sauberen und hellblau-grünen Farbton. Es ist halbtransparent, weist eine geringe Opazität, ausgezeichnete Lichtechtheit und Alkalibeständigkeit auf.
- Die crzweiODER3 Es ist nicht als gefährliches Material eingestuft und gilt als inertes feines Pulver. Es unterliegt nicht den internationalen Transportvorschriften.
- Es reizt weder die Haut noch die Schleimhäute.
Anwendungen
In der Keramik- und Glasindustrie
Aufgrund seiner hohen Wärmebeständigkeit und chemischen Beständigkeit ist CrzweiODER3 kalziniert wird als Farbstoff oder verglastes Pigment bei der Herstellung von Keramik, in Porzellanlacken und Glasmischungen verwendet.
In Industrielacken
Chrom (III) -oxidkeramik bietet eine hervorragende Beständigkeit gegen die meisten korrosiven Umgebungen. All dies durch den Mechanismus des Ausschlusses des Substrats aus der Umgebung, die es umgibt..
Aus diesem Grund wird es in Beschichtungen verwendet, um die Korrosion vieler Materialien zu verhindern, die durch thermisches Sprühen (Zerstäubung oder Heißsprühen) aufgebracht werden..
Es wird auch als Schutz gegen Abrieb verwendet (wenn der Materialabtrag durch Partikel verursacht wird, die sich über eine Oberfläche bewegen)..
In diesen Fällen ist das Aufbringen einer Beschichtung aus CrzweiODER3 erzeugt durch Plasmaabscheidung eine hohe Abriebfestigkeit.
Die beiden vorhergehenden Fälle sind beispielsweise bei Gasturbinentriebwerken in der Luft- und Raumfahrtindustrie nützlich..
In der feuerfesten Industrie
Wird zur Herstellung von thermisch und chemisch beständigen Ziegeln, Verkleidungsmaterialien und feuerfestem Beton auf Aluminiumoxidbasis verwendet.
Im Aufbau
Da es extrem widerstandsfähig gegen atmosphärische Bedingungen, Licht und Hitze ist, wird es als granulierter Gesteinsfarbstoff für Asphaltdächer, Betonzement, hochwertige Industrielacke für den Außenbereich, Stahlkonstruktionen und Fassadenbeschichtungen (emulgierbare Farben) verwendet..
Als Pigment in verschiedenen Anwendungen
Es kann Vulkanisationsbedingungen standhalten und wird nicht abgebaut, weshalb es bei der Gummipigmentierung verwendet wird.
Da es ungiftig ist, wird es als Pigment für Spielzeug, Kosmetika (insbesondere sein Hydrat), Kunststoffe, Druckfarben und Farben verwendet, die mit Lebensmitteln und pharmazeutischen Produkten in Kontakt kommen.
In der Pigmentindustrie wird es als Rohstoff zur Herstellung chromhaltiger Penetrationsfarbstoffe und in Pigmenten auf Basis gemischter Metalloxidphasen verwendet. Es wird auch als Farbfarbstoff für die Spulenbeschichtung verwendet.
Sein Hydrat hat eine Transparenz, die die Formulierung von polychromatischen Oberflächen in der Automobilindustrie (Metalloberflächen von Automobilen) ermöglicht..
Aufgrund seiner einzigartigen Eigenschaft, Infrarotstrahlung (IR) ähnlich wie Chlorophyll in Pflanzen zu reflektieren, sieht es unter Infrarotlicht wie Laub aus. Aus diesem Grund wird es häufig in Tarnfarben oder -beschichtungen für militärische Anwendungen verwendet..
In Schmuck
Es wird als Farbstoff für synthetische Edelsteine verwendet. Wenn Cr eingeführt wirdzweiODER3 als Verunreinigung im Kristallgitter von α-AlzweiODER3, Wie beim Halbedelstein Rubin ist die Farbe rot statt grün.
Aufgrund seiner hohen Härte und Abriebeigenschaften wird es auch als Schleif- und Poliermittel verwendet..
Bei der Katalyse chemischer Reaktionen
Unterstützt in Aluminiumoxid (AlzweiODER3) oder anderen Oxiden wird es in der organischen Chemie als Katalysator verwendet, beispielsweise bei der Hydrierung von Estern oder Aldehyden zu Alkoholen und bei der Cyclisierung von Kohlenwasserstoffen. Katalysiert die Stickstoffreaktion (N.zwei) mit Wasserstoff (H.zwei) unter Bildung von Ammoniak (NH3).
Aufgrund seiner Oxidations-Reduktions-Fähigkeit, die zusammen mit Chrom (VI) oxid wirkt, spielt es eine wichtige Rolle bei der Dehydrierung von Alkanen mit CO.zwei Propen und Isobuten herzustellen, da der Deaktivierungs-Reaktivierungs-Zyklus des Katalysators leicht ausführbar ist. Es wird auch als Katalysator in der anorganischen Chemie verwendet.
Bei der Herstellung von Chrom
Es wird zur aluminothermischen Herstellung von reinem Chrommetall verwendet. Dazu muss es auf 1000 ºC erhitzt werden, um die Korngröße zu erhöhen..

Auf magnetischen Materialien
Es wurde in geringen Mengen zu magnetischen Materialien in Audio- und Videobändern hinzugefügt, wodurch den Klangköpfen ein selbstreinigender Effekt verliehen wird..
Neueste Innovationen
Pigmente mit verbessertem Reflexionsvermögen im nahen IR wurden durch Dotieren von Cr-Nanopartikeln erhaltenzweiODER3 mit Salzen von Elementen der Gruppe der Seltenen Erden wie Lanthan und Praseodym.
Durch Erhöhen der Konzentration dieser Elemente steigt das Sonnenreflexionsvermögen im nahen Infrarot, ohne die grüne Farbe des Cr-Pigments zu beeinflussen.zweiODER3.
Dies ermöglicht CrzweiODER3 dotiert als „kaltes“ Pigment, da es zur Kontrolle des Wärmestaus geeignet ist.
Unter anderem bei Decken, Automobilen und Polstern wird ein hohes Reflexionsvermögen des IR-Sonnenlichts erzielt, wodurch die Zunahme der Wärme in der Umgebung erheblich reduziert werden kann.
Verweise
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 19. Vierte Ausgabe. John Wiley & Sons.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. Band A7 und A20. VCH Verlagsgesellschaft mbH.
- Amerikanische Elemente. (2019). Chrom (III) oxid. Von americanelements.com wiederhergestellt.
- Nationalbibliothek für Medizin. (2019). Chrom (III) oxid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Dorfman, Mitchell R. (2012). Thermische Spritzbeschichtungen. Im Handbuch zur Umweltzerstörung von Materialien. Kapitel 19. Von sciencedirect.com wiederhergestellt.
- Takehira, K. et al. (2004). COzwei Dehydrierung von Propan über Cr-MCM-41-Katalysator. In Studien in Oberflächenwissenschaften und Katalyse 153. Von sciencedirect.com wiederhergestellt.
- Selvam Sangeetha et al. (2012). Funktionelle Pigmente aus Chrom (III) -oxid-Nanopartikeln. Dyes and Pigments 94 (2012) 548 & ndash; 552. Von sciencedirect.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.