
Eigenschaften, Struktur, Verwendung von Chloroxid (V)
Das Chloroxid (V) ist eine sehr instabile anorganische Verbindung mit der chemischen Formel ClzweiODER5. Es ist eines der vielen Chloroxide, die sich durch molekulare oder sogar radikalische Spezies auszeichnen.
Das ClzweiODER5 Es hat nur in Papier und theoretischen Berechnungen Leben gefunden; Es wurde jedoch nicht ausgeschlossen, dass es existiert, und es ist wahrscheinlich, dass einige charakterisiert werden können (durch fortgeschrittene Spektroskopietechniken). Was aus allgemeinen chemischen Konzepten dieses Oxids vorhergesagt werden kann, ist, dass es das Anhydrid der Chlorsäure HClO ist3.
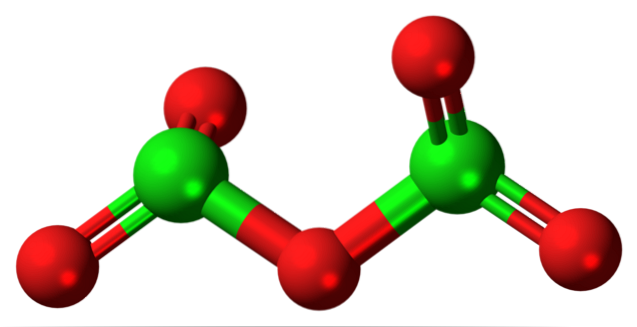
Das hypothetische Chlor (V) oxidmolekül ist oben gezeigt. Da es sich um ein Molekül handelt, wird das Vorhandensein des Cl-Ions überhaupt nicht berücksichtigt+5;; noch weniger, wenn es eine solche Polarisationskraft haben muss, um Sauerstoff zur kovalenten Bindung zu zwingen.
Wie alle instabilen Verbindungen setzt es Energie frei, um in stabilere Produkte zu zerfallen. Prozess, der in vielen Fällen explosiv ist. Wenn der ClzweiODER5 zerlegt Releases ClOzwei michzwei. Es wird vermutet, dass in Wasser in Abhängigkeit vom Isomer von ClzweiODER5, kann verschiedene Chloroxosäuren bilden.
Artikelverzeichnis
- 1 Eigenschaften
- 2 Struktur von Chloroxid (V)
- 2.1 Molekül
- 2.2 Lewis-Struktur
- 2.3 Isomere und ihre jeweilige Hydrolyse
- 3 Nomenklatur
- 4 Verwendungen
- 5 Referenzen
Eigenschaften
Die Molmasse von ClzweiODER5 es ist 150,9030 g / mol. Aus dieser Masse und ihrem hypothetischen Molekül kann vermutet werden, dass es sich wahrscheinlich um eine ölige Flüssigkeit handeln würde, wenn sie isoliert werden könnte. Natürlich, wenn man es mit dem physischen Erscheinungsbild des Cl vergleichtzweiODER7.
Obwohl es nicht isoliert oder charakterisiert werden kann, ist dieses Chloroxid sauer, kovalent und muss auch ein kleines Dipolmoment aufweisen. Sein Säuregehalt ist verständlich, wenn die chemische Gleichung seiner Hydrolyse analysiert wird:
ClzweiODER5 + H.zweiO 2HClO3
Das HClO sein3 Chlorsäure. Die Umkehrreaktion würde dazu führen, dass die Säure dehydratisiert werden kann:
2HClO3 => ClzweiODER5 + H.zweiODER
Auf der anderen Seite, wenn der ClzweiODER5 kaum produziert, zersetzt es sich:
2ClzweiODER5 => 4ClOzwei + ODERzwei
Es handelt sich also eher um eine Zwischenart als um ein Oxid. Seine Zersetzung muss so schnell sein (wenn man bedenkt, dass sogar ClzweiODER5), die mit aktuellen instrumentellen Analysetechniken nicht erkannt wurde.
Struktur von Chloroxid (V)
Molekül
Im oberen Bild wurde die Struktur des hypothetischen Cl-Moleküls gezeigt.zweiODER5 mit einem Modell von Kugeln und Balken. Die roten Kugeln repräsentieren Sauerstoffatome und die grünen Kugeln repräsentieren Chloratome. Jedes Chlor hat eine trigonale Pyramidenumgebung, daher muss seine Hybridisierung sp3.
Somit ist das Molekül von ClzweiODER5 es kann als zwei trigonale Pyramiden gesehen werden, die durch einen Sauerstoff verbunden sind. Wenn Sie jedoch genau hinschauen, richtet eine Pyramide ihre Sauerstoffatome nach unten aus, die andere aus der Ebene (in Richtung des Lesers)..
Daher wird angenommen, dass es Rotationen in der O-Verbindung gibtzweiCl-O-ClOzwei, das Molekül relativ dynamisch machen. Beachten Sie, dass die Formel O.zweiCHLOClOzwei ist eine Möglichkeit, die Struktur von Cl darzustellenzweiODER5.
Lewis-Struktur
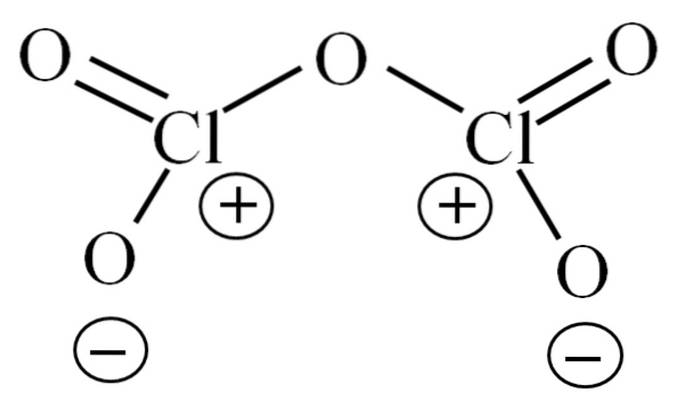
Bis jetzt hat das Molekül selbst nicht ermöglicht, zu entziffern, worauf seine Instabilität zurückzuführen ist. Um diese Frage zu beleuchten, wenden wir uns der oben dargestellten Lewis-Struktur zu. Beachten Sie, dass die Struktur fälschlicherweise als flach angesehen werden kann, aber im vorherigen Unterabschnitt wurde klargestellt, dass dies nicht der Fall ist..
Warum haben beide Chloratome positive formale Ladungen? Weil Chlor noch ein freies Elektronenpaar hat, was durch Anwendung der Valencia-Bindungstheorie (die hier zur Vereinfachung nicht durchgeführt wird) überprüft werden kann. Somit ist seine formale Belastung:
C.F. = 7 - (4 + 2) = 1
Und was hat das mit ihrer Instabilität zu tun? Nun, Chlor ist beträchtlich elektronegativ und daher ein schlechter Träger positiver formaler Ladungen. Dies kehrt zum Cl zurückzweiODER5 eine stark saure Spezies, da sie Elektronen gewinnen muss, um den elektronischen Bedarf für die beiden Chloratome zu decken.
Das Gegenteil passiert mit dem BrzweiODER5 und das ichzweiODER5, Oxide, die unter normalen Bedingungen existieren. Dies liegt daran, dass sowohl Brom als auch Jod weniger elektronegativ sind als Chlor; und deshalb unterstützen sie die positive formelle Anklage besser.
Isomere und ihre jeweilige Hydrolyse
Bisher ist die ganze Erklärung auf eines der beiden Isomere von Cl gefallenzweiODER5: Das ÖzweiCHLOClOzwei. Welches ist das andere? Das Ö3CHLOClO. In diesem Isomer fehlen den Chlor formalen positiven Ladungen und sie sollten daher ein stabileres Molekül sein. Sowohl die O.zweiCHLOClOzwei wie der O.3ClOClO sollte Hydrolysereaktionen eingehen:
ODERzweiCl-O-ClOzwei + H.zweiO => 2OzweiCl-OH (die nichts anderes als HClO sind3)
ODER3Cl-O-ClO + H.zweiO => O.3Cl-OH (HClO4) + HO-ClO (HClOzwei)
Es ist zu beachten, dass bis zu drei Chloroxosäuren gebildet werden können: HClO3, HClO4 und HClOzwei
Nomenklatur
Sein Name "Chloroxid (V)" entspricht dem Namen, der gemäß der Bestandsnomenklatur vergeben wurde. Das ClzweiODER5 Es kann auch zwei andere Namen haben: Dichlorpentaoxid und Chlorsäureanhydrid, die durch die systematische bzw. traditionelle Nomenklatur zugeordnet werden..
Anwendungen
Das Cl ist mehr als nur eine Motivation für ComputerstudienzweiODER5 Es wird erst verwendet, wenn es entdeckt, isoliert, charakterisiert, gelagert und beim geringsten Kontakt nicht explodiert..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Sandra Luján Quiroga und Luis José Perissinotti. (2011). Chloroxosäuren und Struktur von Dichloroxiden. Chem. Educator, Vol. 16.
- Chemische Formulierung. (2019). Chloroxid (V). Wiederhergestellt von: formulacionquimica.com
- Linus Pauling. (1988). Allgemeine Chemie. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Enzyklopädie der Erdalkaliverbindungen. Elsevier.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.