
Chlor (III) -oxid-Eigenschaften, Struktur, Verwendung
Das Chlor (III) oxid ist eine anorganische Verbindung, deren chemische Formel Cl istzweiODER3. Entspricht Chlorsäureanhydrid, HClOzwei. Es ist ein dunkelbrauner Feststoff, der selbst bei Temperaturen unter 0 ° C hochexplosiv und schlecht charakterisiert ist. Deshalb ist es ein Gegenstand von Interesse für Computerstudien..
Chemisch gesehen ist es ein kovalentes Oxid, daher gibt es Cl-O-Bindungen und ein diskretes Cl-MolekülzweiODER3 (unteres Bild). Ein solches Molekül kann gut durch Dehydratisieren von HClO gebildet werdenzwei, oder es einer Photolyse bei niedrigen Temperaturen unterziehen. Das Detail ist, dass es sich unter Bildung von Cl zersetztzwei, ODERzwei, oder andere thermodynamisch stabile Chloroxide.
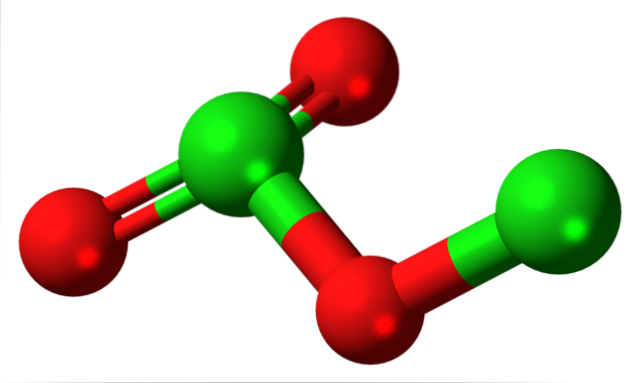
Da Cl-O-Bindungen schlecht polar sind, ist das Cl-MolekülzweiODER3 hat ein kleines Dipolmoment; Daher löst es sich nicht gut in Wasser und interagiert nicht mit anderen polaren Lösungsmitteln. Seine Instabilität ist derart, dass es weder für kommerzielle oder potenzielle Zwecke bekannt ist (noch wäre seine Anwendbarkeit als Sprengstoff realisierbar)..
Der Hauptgrund für seine Instabilität kann in den elektronischen Eigenschaften des vermeintlichen Cl liegen3+ (unter der Annahme eines rein ionischen Charakters). Tatsächlich sind seine Oxidationsstufen +1 und +5 am stabilsten, wenn Chlor mit Sauerstoff Verbindungen bildet..
Artikelverzeichnis
- 1 Eigenschaften
- 2 Struktur von Chlor (III) oxid
- 2.1 Isomere
- 3 Nomenklatur
- 4 Verwendungen
- 5 Referenzen
Eigenschaften
Da seine Charakterisierung schlecht und schlecht dokumentiert ist, gibt es außer den folgenden Punkten nicht viel zu seinen Eigenschaften zu sagen:
-Es hat eine Molmasse von 118,903.
-Es ist ein festes Dunkelbraun; obwohl es gasförmiges Chlor sublimieren kann und gelblich grüne Dämpfe abgibt.
-Es fehlt sowohl ein Siedepunkt als auch ein Schmelzpunkt, da es bei 0 ° C explodiert (und auch bei kälteren Temperaturen)..
-Die Löslichkeit in Wasser wird auf etwa 3,42 g / 100 ml geschätzt, was beweist, dass es sich um ein kovalentes Molekül mit geringer Polarität handelt..
-Reagiert mit Wasser (dem Wenigen, das sich auflöst) zu HClOzwei::
ClzweiODER3 + H.zweiODER <=> 2HClOzwei
Struktur von Chlor (III) oxid
Das Bild zeigte die molekulare Struktur von ClzweiODER3 mit einem Modell von Kugeln und Balken. Obwohl es auf den ersten Blick nicht so scheint, sind die unausgesprochenen Auswirkungen Ihrer Links und räumlichen Anordnungen komplizierter als sie erscheinen. Diese Struktur entspricht einem der vielen möglichen Isomere für diese Verbindung..
Die roten Kugeln entsprechen Sauerstoffatomen und die grünen Kugeln Chloratomen. Das Chlor links hat eine trigonale Pyramidengeometrie mit einem Paar freier Elektronen; es kann also angenommen werden, dass ihre Hybridisierung sp sein muss3. Ein Sauerstoffatom fungiert als Brücke zwischen den beiden Chloratomen Cl-O-Cl.
Isomere
Was sind die anderen Isomere? Theoretisch werden neun berechnet, von denen vier am stabilsten sind (einschließlich der im Bild). Die anderen drei hätten Strukturen wie:
-ClClO3. Sehr ähnlich der erklärten, jedoch mit einer Cl-Cl-Bindung.
-ClOOOCl (1). In diesem Isomer befindet sich eine Brücke aus drei Sauerstoffatomen, die die beiden Chloratome trennen (denken Sie an die Winkelgeometrie von H.zweiOder um es zu visualisieren).
-ClOOOCl (2). Die gleiche sauerstoffhaltige Brücke ist auch in diesem Isomer vorhanden, mit der Ausnahme, dass die beiden Chloratome im Raum verdeckt sind; einander gegenüberliegend, während sie im obigen Isomer entfernt sind.
Nomenklatur
Sein Name, Chloroxid (III), entspricht dem Namen, der gemäß der Bestandsnomenklatur vergeben wurde. Hier wird angenommen, dass Chlor eine Oxidationsstufe von +3 hat; es bedeutet aber nicht, dass das Cl-Kation3+ kann vorhanden sein. Es ist ein Molekül, kein Ionennetzwerk.
Ein anderer Name, unter dem Cl auch bekannt istzweiODER3 ist nach der systematischen Nomenklatur Dichlortrioxid.
Und schließlich, nicht so häufig (obwohl es der traditionellen Nomenklatur unterliegt), gibt es den Namen Chlorsäureanhydrid, der sich auf diese Verbindung bezieht. Dieser Name ist darauf zurückzuführen, dass, wie bereits erläutert, der ClzweiODER3 tritt auf, wenn HClOzwei kondensiert und setzt Wasser frei.
Anwendungen
Da es sich um ein Chloroxid handelt, ist die unmittelbarste Verwendung, die für Cl in Betracht gezogen werden könntezweiODER3 Es ist wie ein Oxidationsmittel, das organische Verunreinigungen und Mikroben neutralisieren kann. Es ist jedoch sowohl sehr instabil als auch explosiv, so dass es für diesen Zweck nicht einmal als nützlich angesehen wird..
Sicher gibt es keine Informationen darüber, wie sich das Cl verhalten würde.zweiODER3 unter enormem Druck (wenn es dabei nicht explodiert). Unter normalen Bedingungen scheint es nichts weiter als ein relativ stabiles und differenzierbares Zwischenprodukt zwischen anderen stabileren Chloroxiden zu sein..
Computergestützt war es jedoch Gegenstand der Untersuchung, freie Radikalmechanismen zu bestimmen, an denen verschiedene Arten von Chlor und Sauerstoff beteiligt sind..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Dichlortrioxid. Wiederhergestellt von: en.wikipedia.org
- Dale L. Perry. (2011). Handbuch anorganischer Verbindungen. (zweite Ausgabe). CRC Press Taylor & Francis Group.
- Richard C. Ropp. (2013). Enzyklopädie der Erdalkaliverbindungen. Elsevier.
- Kim K. H., Han Y. K. und Lee Y. S. (1999). Basissatzeffekte auf die Stabilität der Cl2O3-Isomere unter Verwendung der B3P86- und B3LYP-Methoden der Dichtefunktionaltheorie. Journal of Molecular Structure THEOCHEM 460 (1-3): 19-25.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.