
Voltammetrie, woraus es besteht, Typen und Anwendungen
Das Voltammetrie Es ist eine elektroanalytische Technik, die Informationen einer chemischen Spezies oder eines Analyten aus den elektrischen Strömen bestimmt, die durch die Änderung eines angelegten Potentials erzeugt werden. Das heißt, das angelegte Potential E (V) und die Zeit (t) sind die unabhängigen Variablen; während der Strom (A) die abhängige Variable.
Die chemische Spezies muss normalerweise elektroaktiv sein. Was bedeutet das? Dies bedeutet, dass es Elektronen verlieren (oxidieren) oder gewinnen (reduzieren) muss. Damit die Reaktion beginnt, muss die Arbeitselektrode das notwendige Potential liefern, das theoretisch durch die Nernst-Gleichung bestimmt wird.
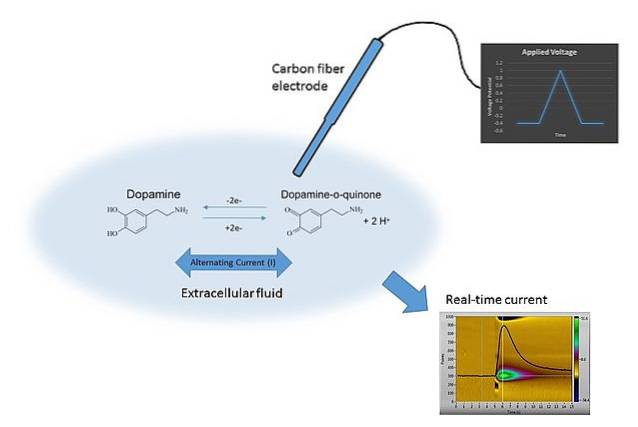
Ein Beispiel für die Voltammetrie ist im obigen Bild zu sehen. Die Elektrode im Bild besteht aus Kohlenstofffasern, die in das Auflösungsmedium eingetaucht sind. Dopamin oxidiert nicht und bildet zwei Carbonylgruppen C = O (rechte Seite der chemischen Gleichung), es sei denn, das richtige Potential wird angelegt.
Dies wird erreicht, indem E mit unterschiedlichen Werten abgetastet wird, die durch viele Faktoren wie die Lösung, die vorhandenen Ionen, dieselbe Elektrode und Dopamin begrenzt sind..
Durch Variation von E über die Zeit werden zwei Graphen erhalten: der erste E v t (das blaue Dreieck) und der zweite die Antwort C gegen t (gelb). Seine Formen sind charakteristisch für die Bestimmung von Dopamin unter den Versuchsbedingungen..
Artikelverzeichnis
- 1 Was ist Voltammetrie??
- 1.1 Voltammetrische Welle
- 1.2 Instrumentierung
- 2 Arten
- 2.1 Pulsvoltammetrie
- 2.2 Wiederauflösungsvoltammetrie
- 3 Anwendungen
- 4 Referenzen
Was ist Voltammetrie??
Die Voltammetrie wurde dank der Erfindung der Polarographietechnik durch den Nobelpreisträger für Chemie 1922, Jaroslav Heyrovsky, entwickelt. Darin wird die Elektrode des Quecksilbertropfens (EGM) ständig erneuert und polarisiert.
Die analytischen Mängel dieser Methode zu dieser Zeit wurden durch die Verwendung und das Design anderer Mikroelektroden behoben. Diese unterscheiden sich enorm im Material, von Kohlenstoff, Edelmetallen, Diamanten und Polymeren bis hin zu Design, Scheiben, Zylindern und Blechen. und auch in der Art und Weise, wie sie mit der Lösung interagieren: stationär oder rotierend.
Alle diese Details sollen die Polarisation der Elektrode begünstigen, die einen Abfall des registrierten Stroms verursacht, der als Grenzstrom bekannt ist (d.h.1). Dies ist proportional zur Konzentration des Analyten und zur Hälfte der Wirksamkeit E (E.1/2), um die Hälfte des Stroms zu erreichen (i1/2) ist charakteristisch für die Art.
Dann Bestimmen der Werte von E.1/2 auf der Kurve, wo der Strom mit der Variation von E erhalten wird, genannt Voltamperogramm, Das Vorhandensein eines Analyten kann identifiziert werden. Das heißt, jeder Analyt hat unter den Bedingungen des Experiments seinen eigenen Wert von E.1/2.
Voltammetrische Welle
In der Voltammetrie arbeiten Sie mit vielen Graphen. Die erste davon ist die E-gegen-t-Kurve, die es ermöglicht, die angelegten Potentialdifferenzen als Funktion der Zeit zu verfolgen.
Gleichzeitig zeichnet der Stromkreis die vom Analyten erzeugten C-Werte auf, indem er Elektronen in der Nähe der Elektrode verliert oder gewinnt..
Da die Elektrode polarisiert ist, kann weniger Analyt aus der Lösung in sie diffundieren. Wenn zum Beispiel die Elektrode positiv geladen ist, ist die Spezies X.- wird von ihm angezogen und wird durch bloße elektrostatische Anziehung darauf zugehen.
Aber X.- Sie sind nicht allein: In Ihrer Umgebung sind andere Ionen vorhanden. Einige Kationen M.+ Sie können der Elektrode im Weg stehen, indem sie sie in "Cluster" positiver Ladungen einschließen. und ebenso N Anionen- kann sich um die Elektrode verfangen und X verhindern- Ich bin zu ihm gekommen.
Die Summe dieser physikalischen Phänomene führt dazu, dass Strom verloren geht. Dies wird in der C-gegen-E-Kurve und ihrer Form beobachtet, die der eines S ähnelt, das als Sigmoidform bezeichnet wird. Diese Kurve ist als voltammetrische Welle bekannt..
Instrumentierung
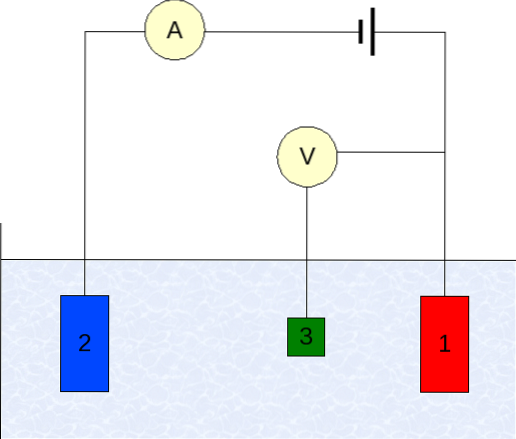
Die Instrumentierung der Voltammetrie variiert je nach Analyt, Lösungsmittel, Elektrodentyp und Anwendung. Die überwiegende Mehrheit von ihnen basiert jedoch auf einem System aus drei Elektroden: eine für die Arbeit (1), eine Hilfselektrode (2) und die Referenzelektrode (3)..
Die hauptsächlich verwendete Referenzelektrode ist die Kalomelelektrode (ECS). Dies ermöglicht es zusammen mit der Arbeitselektrode, eine Potentialdifferenz ΔE herzustellen, da das Potential der Referenzelektrode während der Messungen konstant bleibt..
Andererseits ist die Hilfselektrode dafür verantwortlich, die Ladung zu steuern, die zur Arbeitselektrode gelangt, um sie innerhalb akzeptabler E-Werte zu halten. Die unabhängige Variable, die angelegte Potentialdifferenz, wird durch Addition der Potentiale der Arbeits- und Referenzelektrode erhalten..
Typen

Das obige Bild zeigt ein E-gegen-t-Diagramm, das auch als Potentialwelle für eine lineare Sweep-Voltammetrie bezeichnet wird..
Es ist ersichtlich, dass mit der Zeit das Potenzial zunimmt. Dieser Sweep erzeugt wiederum eine Antwortkurve oder ein Voltamperogramm C gegen E, deren Form sigmoid sein wird. Es wird einen Punkt geben, an dem unabhängig davon, wie viel E zunimmt, der Strom nicht zunimmt.
Andere Arten der Voltammetrie können aus diesem Diagramm abgeleitet werden. Wie? Modifizieren der Potentialwelle E gegen t durch plötzliche Potentialimpulse nach bestimmten Mustern. Jedes Muster ist mit einer Art Voltammetrie verbunden und umfasst seine eigene Theorie und experimentelle Bedingungen..
Pulsvoltammetrie
Bei dieser Art der Voltammetrie können Gemische von zwei oder mehr Analyten analysiert werden, deren E-Werte analysiert werden können1/2 sind sehr nah beieinander. Somit ist ein Analyt mit E.1/2 von 0,04 V kann in Begleitung eines anderen mit einem E identifiziert werden1/2 von 0,05 V. Bei der linearen Sweep-Voltammetrie muss die Differenz größer als 0,2 V sein.
Daher gibt es eine höhere Empfindlichkeit und niedrigere Nachweisgrenzen; d.h. Analyten können bei sehr niedrigen Konzentrationen bestimmt werden.
Potentialwellen können ähnliche Muster wie Treppen, geneigte Treppen und Dreiecke aufweisen. Letzteres entspricht der Cyclovoltammetrie (CV für sein Akronym in Englisch, erstes Bild).
In CV wird ein Potential E in einer Richtung angelegt, positiv oder negativ, und dann wird bei einem bestimmten Wert von E zum Zeitpunkt t das gleiche Potential erneut angelegt, jedoch in der entgegengesetzten Richtung. Bei der Untersuchung der erzeugten Voltamperogramme zeigen die Maxima das Vorhandensein von Zwischenprodukten bei einer chemischen Reaktion.
Wiederauflösungsvoltammetrie
Dies kann vom anodischen oder kathodischen Typ sein. Es besteht aus der galvanischen Abscheidung des Analyten auf einer Quecksilberelektrode. Wenn der Analyt ein Metallion ist (wie Cdzwei+) bildet sich ein Amalgam; und wenn es ein Anion ist (wie MoO4zwei-) ein unlösliches Quecksilbersalz.
Dann werden Potentialimpulse angelegt, um die Konzentration und Identität der galvanisch abgeschiedenen Spezies zu bestimmen. Somit wird das Amalgam wie Quecksilbersalze wieder aufgelöst.
Anwendungen
-Die anodische Voltammetrie mit erneuter Auflösung wird verwendet, um die Konzentration gelöster Metalle in der Flüssigkeit zu bestimmen.
-Es ermöglicht die Untersuchung der Kinetik von Redox- oder Adsorptionsprozessen, insbesondere wenn die Elektroden zum Nachweis eines bestimmten Analyten modifiziert werden.
-Seine theoretische Grundlage wurde für die Herstellung von Biosensoren verwendet. Mit diesen kann das Vorhandensein und die Konzentration von biologischen Molekülen, Proteinen, Fetten, Zuckern usw. bestimmt werden..
-Schließlich wird die Beteiligung von Vermittlern an den Reaktionsmechanismen festgestellt.
Verweise
- González M. (22. November 2010). Voltammetrie. Wiederhergestellt von: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E. & Vivó, M. (2002). Elektrochemische Analyse. Journal of Biological Diagnosis, 51 (1), 18-27. Von scielo.isciii.es wiederhergestellt
- Chemie und Wissenschaft. (18. Juli 2011). Voltammetrie. Wiederhergestellt von: laquimicaylaciencia.blogspot.com
- Quiroga A. (16. Februar 2017). Cyclovoltammetrie. Wiederhergestellt von: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Voltammetrische Techniken. [PDF]. Tufts University. Wiederhergestellt von: brown.edu
- Tag R. & Underwood A.. Quantitative analytische Chemie (fünfte Ausgabe). PEARSON Prentice Hall.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.