
Transaminierungsmechanismus, Funktion und Beispiele
Das Transaminierung ist eine Art chemischer Reaktion, die bei der "Umverteilung" von Aminogruppen zwischen Aminosäuren funktioniert, da sie reversible Aminierungsprozesse (Addition einer Aminogruppe) und Desaminierung (Eliminierung einer Aminogruppe) beinhaltet, die durch bestimmte bekannte Enzyme katalysiert werden als Transaminasen oder Aminotransferasen.
Die allgemeine Transaminierungsreaktion beinhaltet den Austausch zwischen einer Aminosäure und einer beliebigen α-Ketosäure, wobei der Austausch einer Aminogruppe die Ketosäureversion der ersten Substrataminosäure und die Aminosäureversion der ersten Substrat-α-Ketosäure ergibt..

Die Aminogruppe, die normalerweise ausgetauscht wird, ist das "Alpha" -Amino, dh diejenige, die an der Bildung von Peptidbindungen beteiligt ist und die Struktur von Aminosäuren definiert, obwohl auch Reaktionen auftreten können, an denen andere Aminogruppen beteiligt sind, die an verschiedenen Positionen vorliegen..
Mit Ausnahme von Lysin, Threonin, Prolin und Hydroxyprolin sind alle Aminosäuren an Transaminierungsreaktionen beteiligt, obwohl Transaminasen für Histidin, Serin, Methionin und Phenylalanin beschrieben wurden, aber ihre Stoffwechselwege beinhalten diese Art von Reaktionen nicht.
Die Transaminierungsreaktionen zwischen Aminosäuren und α-Ketosäuren wurden 1937 von Braunstein und Kritzmann entdeckt und sind seitdem Gegenstand intensiver Studien, da sie in vielen Geweben verschiedener Organismen und mit unterschiedlichen Zwecken auftreten..
Beispielsweise sind Transaminasen beim Menschen in Körpergeweben weit verbreitet und besonders aktiv in Herzmuskelgewebe, Leber, Skelettmuskelgewebe und Nieren..
Artikelverzeichnis
- 1 Reaktionsmechanismus
- 2 Funktion der Transaminierung
- 3 Beispiele
- 4 Referenzen
Reaktionsmechanismus
Transaminierungsreaktionen beinhalten mehr oder weniger den gleichen Mechanismus. Wie oben diskutiert, treten diese Reaktionen als reversibler Austausch einer Aminogruppe zwischen einer Aminosäure und einer α-Ketosäure (desaminiert) auf, wobei die α-Ketosäure der Donoraminosäure und die Aminosäure der α-Ketosäure erzeugt werden Rezeptor..
Diese Reaktionen hängen von einer Verbindung ab, die als Pyridoxalphosphat bekannt ist, einem Derivat von Vitamin B6, das als Transporter von Aminogruppen beteiligt ist und an Transaminaseenzyme durch Bildung einer Schiffschen Base zwischen der Aldehydgruppe dieses Moleküls und dem ε-Amino bindet eines Lysinrests im aktiven Zentrum des Enzyms.
Die Bindung zwischen Pyridoxalphosphat und dem Lysinrest im aktiven Zentrum ist nicht kovalent, sondern erfolgt durch die elektrostatische Wechselwirkung zwischen der positiven Ladung von Stickstoff auf Lysin und der negativen Ladung auf der Phosphatgruppe von Pyridoxal.
Im Verlauf der Reaktion verdrängt die Aminosäure, die als Substrat fungiert, die ε-Aminogruppe des Lysinrests im aktiven Zentrum, das mit Pyridoxal an der Schiffschen Base beteiligt ist.
Währenddessen wird ein Elektronenpaar aus dem Alpha-Kohlenstoff der Aminosäure entfernt und auf den Pyridinring übertragen, aus dem Pyridoxalphosphat besteht (positiv geladen), und dann an die α-Ketosäure "abgegeben", die als zweites Substrat fungiert..
Auf diese Weise ist Pyridoxalphosphat nicht nur am Transfer oder Transport von Aminogruppen zwischen Aminosäuren und α-Ketosäuren beteiligt, die Substrate von Transaminasen sind, sondern wirkt auch als "Senke" von Elektronen und erleichtert die Dissoziation der Alpha-Aminosäure Wasserstoff.
Zusammenfassend überträgt das erste Substrat, eine Aminosäure, seine Aminogruppe auf Pyridoxalphosphat, von wo es anschließend auf das zweite Substrat, eine α-Ketosäure, übertragen wird, wobei in der Zwischenzeit eine Zwischenverbindung gebildet wird, die als Pyridoxaminphosphat bekannt ist..
Funktion der Transaminierung
Transaminaseenzyme kommen im Allgemeinen im Cytosol und in den Mitochondrien vor und wirken bei der Integration verschiedener Stoffwechselwege.
Glutamatdehydrogenase kann beispielsweise in ihrer Umkehrreaktion Glutamat in Ammonium, NADH (oder NADPH) und α-Ketoglutarat umwandeln, die in den Tricarbonsäurezyklus eintreten und bei der Energieerzeugung eine Rolle spielen können.
Dieses Enzym, das sich in der mitochondrialen Matrix befindet, stellt einen Verzweigungspunkt dar, der Aminosäuren mit dem Energiestoffwechsel assoziiert. Wenn einer Zelle genügend Energie in Form von Kohlenhydraten oder Fetten fehlt, um zu funktionieren, kann sie alternativ einige Aminosäuren für dieselbe verwenden Zweck.
Die Bildung des Enzyms (Glutamatdehydrogenase) während der Gehirnentwicklung ist für die Kontrolle der Ammoniumentgiftung wesentlich, da gezeigt wurde, dass einige Fälle von geistiger Behinderung mit einer geringen Aktivität davon zu tun haben, was zu einer Ammoniumbildung führt, die ist schädlich für die Gesundheit des Gehirns.
In einigen Leberzellen können Transaminierungsreaktionen auch zur Synthese von Glucose durch Gluconeogenese verwendet werden.
Glutamin wird durch das Enzym Glutaminase in Glutamat und Ammonium umgewandelt. Glutamat wird dann in α-Ketoglutarat umgewandelt, das in den Krebszyklus und dann in die Glukoneogenese eintritt. Dieser letzte Schritt erfolgt dank der Tatsache, dass Malat, eines der Produkte der Route, mittels eines Shuttles aus den Mitochondrien transportiert wird..
Dieses Shuttle überlässt α-Ketoglutarat dem Apfelsäureenzym, das es in Pyruvat umwandelt. Zwei Pyruvatmoleküle können dann durch Glukoneogenese in ein Glucosemolekül umgewandelt werden..
Beispiele
Die häufigsten Transaminierungsreaktionen beziehen sich auf die Aminosäuren Alanin, Glutaminsäure und Asparaginsäure..
Einige Aminotransferaseenzyme können zusätzlich zu Pyridoxalphosphat Pyruvat als „Coenzym“ verwenden, wie beispielsweise Glutamat-Pyruvat-Transaminase, die die folgende Reaktion katalysiert:
Glutamat + Pyruvat ↔ Alanin + α-Ketoglutarat
Muskelzellen sind auf diese Reaktion angewiesen, um aus Pyruvat Alanin zu produzieren und über den Krebszyklus über α-Ketoglutarat Energie zu gewinnen. In diesen Zellen hängt die Verwendung von Alanin als Energiequelle von der Eliminierung von Aminogruppen wie Ammoniumionen in der Leber über den Harnstoffzyklus ab..
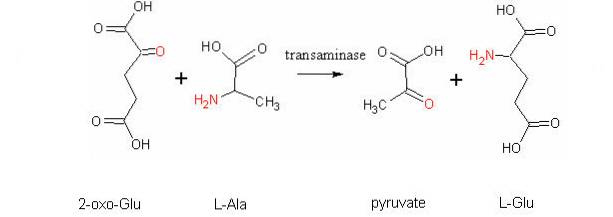
Eine weitere sehr wichtige Transaminierungsreaktion bei verschiedenen Spezies ist die durch das Enzym Aspartataminotransferase katalysierte:
L-Aspartat + α-Ketoglutarat ↔ Oxalacetat + L-Glutamat
Last but not least die Transaminierungsreaktion von γ-Aminobuttersäure (GABA), einer für das Zentralnervensystem essentiellen Nicht-Protein-Aminosäure, die als inhibitorischer Neurotransmitter fungiert. Die Reaktion wird durch eine γ-Aminobuttersäuretransaminase katalysiert und ist ungefähr wie folgt:
α-Ketoglutarat + 4-Aminobutansäure ↔ Glutamat + Bernsteinsemialdehyd
Bernsteinsemialdehyd wird durch eine Oxidationsreaktion in Bernsteinsäure umgewandelt, und letztere kann zur Energieerzeugung in den Krebszyklus eintreten.
Verweise
- Bhagavan, N. V. & Ha, C. E. (2002). Protein- und Aminosäurestoffwechsel. Medical Biochemistry (4. Aufl.), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S. & Cohen, P. P. (1950). Der Umfang der Transaminierungsreaktion in tierischen Geweben. Journal of Biological Chemistry, 187, 439 & ndash; 452.
- Ha, C. E. & Bhagavan, N. V. (2011). Grundlagen der medizinischen Biochemie: mit klinischen Fällen. Akademische Presse.
- Litwack, G. (2017). Humanbiochemie. Akademische Presse.
- Rowsell, E. V. (1956). Transaminierungen mit Pyruvat und anderen α-Ketosäuren. Biochemical Journal, 64 (2), 246.
- Snell, E. E. & Jenkins, W. T. (1959). Der Mechanismus der Transaminierungsreaktion. Journal of Cellular and Comparative Physiology, 54 (S1), 161-177.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.