
Arten chemischer Bindungen

Chemische Bindungen sind die Kräfte, die Atome zusammenhalten die Moleküle zu bilden. Es gibt drei Arten von Bindungen zwischen Atomen:
- Metallische Bindung.
- Ionenverbindung.
- Kovalente Bindung: unpolar, polar, einfach, doppelt, dreifach, Dativ.
Dank dieser Bindungen werden alle Verbindungen gebildet, die in der Natur existieren. Es gibt auch Kräfte, die Moleküle zusammenhalten, sogenannte intermolekulare Bindungen, wie:
- Wasserstoffbrücken oder -bindungen.
- Dipol-Dipol-Kräfte.
Als nächstes erklären wir jeden dieser Links.
| Arten der chemischen Bindung | Charakteristisch | Beispiele | |
|---|---|---|---|
| Metall | Metallionen schweben in einem Meer sich bewegender Elektronen. | Metallelemente: Natrium, Barium, Silber, Eisen, Kupfer. | |
| Ionisch | Übertragung von Elektronen von einem Atom zum anderen. | Natriumchlorid Na+Cl- | |
| Kovalent | Unpolar | Teilen Sie die Elektronen gleichmäßig zwischen zwei Atomen. | Molekularer Wasserstoff H-H oder H.zwei |
| Polar | Teilen Sie Elektronen ungleichmäßig zwischen zwei Atomen. | Wassermolekül H.zweiODER | |
| Einfach | Teile ein Elektronenpaar. | Chlormolekül Clzwei Cl-Cl | |
| Doppelt | Teilen Sie zwei Elektronenpaare. | Sauerstoffmolekül O.zwei O = O. | |
| Verdreifachen | Teilen Sie drei Elektronenpaare. | Stickstoffmolekül N≣N oder N.zwei | |
| Dativ | Nur eines der Atome teilt die Elektronen. | Bindung zwischen Stickstoff und Bor in der Verbindung Ammoniak-Bortrifluorid. | |
| Intermolekularen Kräfte | Wasserstoffbrücke | Die Wasserstoffatome eines Moleküls werden von den elektronegativen Atomen eines anderen Moleküls angezogen. | Wasserstoffbrücken zwischen dem Wasserstoff eines Wassermoleküls und dem Sauerstoff eines anderen Wassermoleküls. |
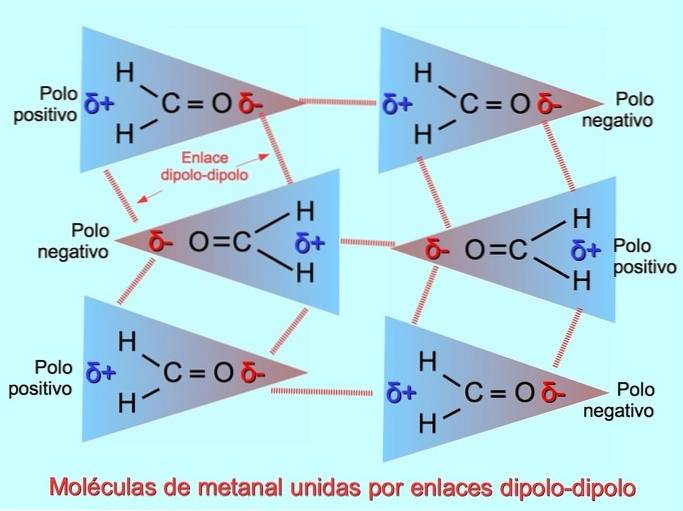
| Dipol-Dipol | Moleküle mit zwei elektrischen Polen ziehen die entgegengesetzten Pole anderer Moleküle an. | Wechselwirkungen zwischen Methanal-H-MolekülenzweiC = O. | |
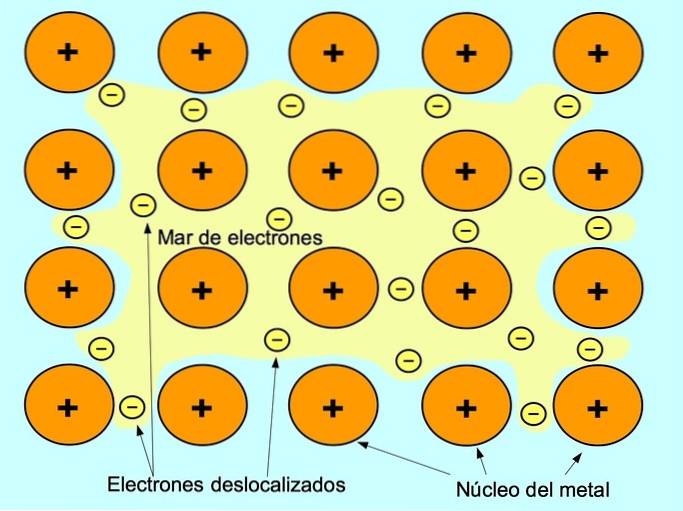
Metallische Bindung
Die metallische Bindung ist die Anziehungskraft zwischen den positiven Ionen der metallischen Elemente und den negativen Elektronen, die sich zwischen den Ionen frei bewegen. Metallatome sind dicht gepackt, wodurch sich Elektronen im Gitter der Atome bewegen können.
In Metallen werden die Valenzelektronen von ihrem ursprünglichen Atom freigesetzt und bilden ein "Meer" von Elektronen, das um die gesamte Metallstruktur schwebt. Dies bewirkt, dass sich die Metallatome in positiv geladene Metallionen umwandeln, die sich zusammenpacken..
Die metallische Bindung wird zwischen metallischen Elementen wie Natrium-Na, Barium-Ba, Calcium-Ca, Magnesium-Mg, Gold-Au, Silber-Ag und Aluminium-Al hergestellt.
Ionenverbindung
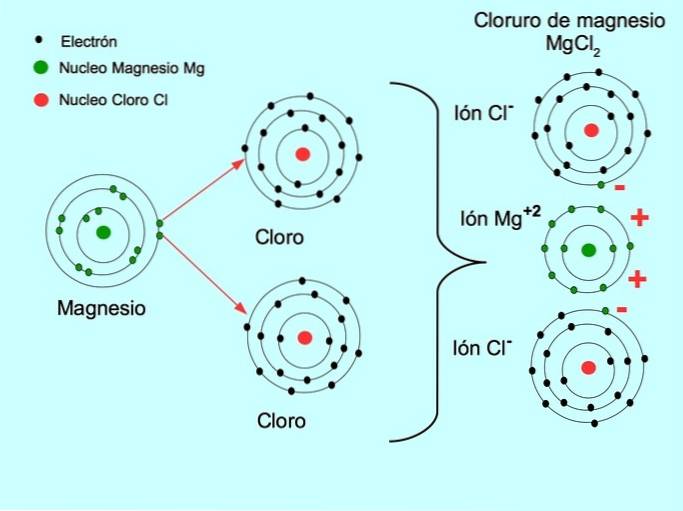
Die Ionenbindung ist die Kraft, die ein metallisches Element wie Natrium oder Magnesium mit einem nichtmetallischen Element wie Chlor oder Schwefel verbindet. Das Metall verliert Elektronen und wandelt sich in ein positives Metallion um Kation. Diese Elektronen gelangen zum nichtmetallischen Element und es wandelt sich in ein negativ geladenes Ion namens um Anion.
Die Kationen und Anionen verbinden sich und bilden ein dreidimensionales Netzwerk, das durch die Kräfte der elektrostatischen Anziehung zwischen den Ionen mit unterschiedlichen Ladungen aufrechterhalten wird. Diese Kräfte bilden ionische Verbindungen.
Die Erdkruste besteht hauptsächlich aus ionischen Verbindungen. Die meisten Gesteine, Mineralien und Edelsteine sind ionische Verbindungen. Beispielsweise:
- Natriumchlorid NaCl: Das metallische Element ist Natrium, das ein Elektron auf Chlor überträgt, das das nichtmetallische Element ist.
- Magnesiumchlorid MgClzwei: Magnesium Mg spendet zwei Elektronen an zwei Chloratome, wie in der folgenden Abbildung gezeigt:
Siehe auch Unterschied zwischen Kationen und Anionen.
Kovalente Bindung
Die kovalente Bindung entsteht, wenn zwei nichtmetallische Atome Elektronen teilen. Diese Bindung kann von verschiedenen Arten sein, abhängig von der Affinität zu den Elektronen der Atome und der Menge der gemeinsam genutzten Elektronen.
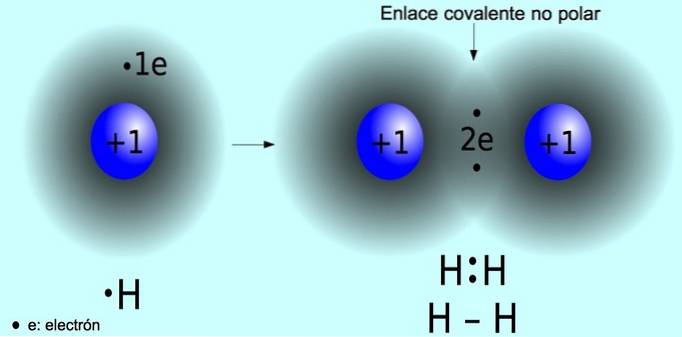
Unpolare kovalente Bindung
Die unpolare kovalente Bindung ist die Bindung, die sich zwischen zwei Atomen bildet, bei denen die Elektronen gleichmäßig verteilt sind. Diese Bindung tritt normalerweise in symmetrischen Molekülen auf, dh in Molekülen, die aus zwei gleichen Atomen bestehen, wie beispielsweise dem Wasserstoffmolekül H.zwei und das Sauerstoffmolekül O.zwei.
Polare kovalente Bindung
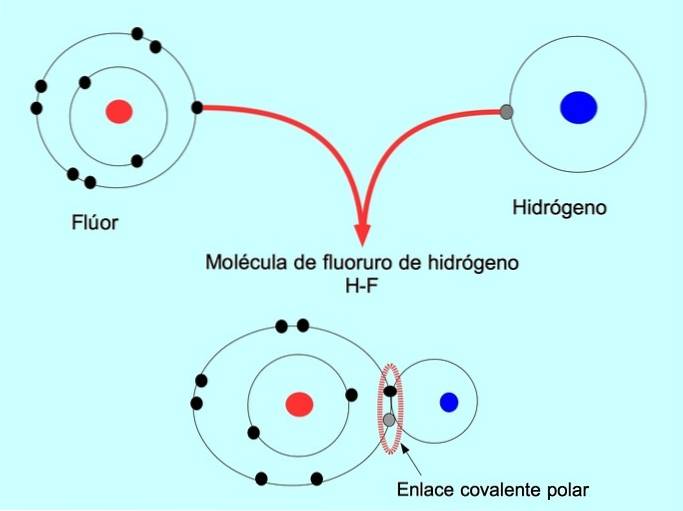
Die polare kovalente Bindung entsteht, wenn zwei Atome Elektronen teilen, aber eines von ihnen eine größere Anziehungskraft für Elektronen hat. Dadurch hat das Molekül einen negativeren "Pol" mit einer größeren Anzahl von Elektronen und der gegenüberliegende Pol ist positiver..
Moleküle mit dieser Verteilung oder diesem Ungleichgewicht der Elektronen werden als polar bezeichnet. Beispielsweise besteht in HF-Fluorwasserstoff eine kovalente Bindung zwischen Wasserstoff und Fluor, aber Fluor hat eine höhere Elektronegativität, so dass es gemeinsam genutzte Elektronen stärker anzieht..
Einfache kovalente Bindung
Wenn zwei Atome zwei Elektronen teilen, jeweils eines von ihnen, wird die gebildete kovalente Bindung als einfache kovalente Bindung bezeichnet.
Zum Beispiel ist Chlor ein Atom, das sieben Valenzelektronen in seiner äußeren Hülle hat, die mit acht Elektronen gefüllt werden können. Ein Chlor kann sich mit einem anderen Chlor verbinden, um das Chlormolekül Cl zu bildenzwei Das ist viel stabiler als Chlor allein.
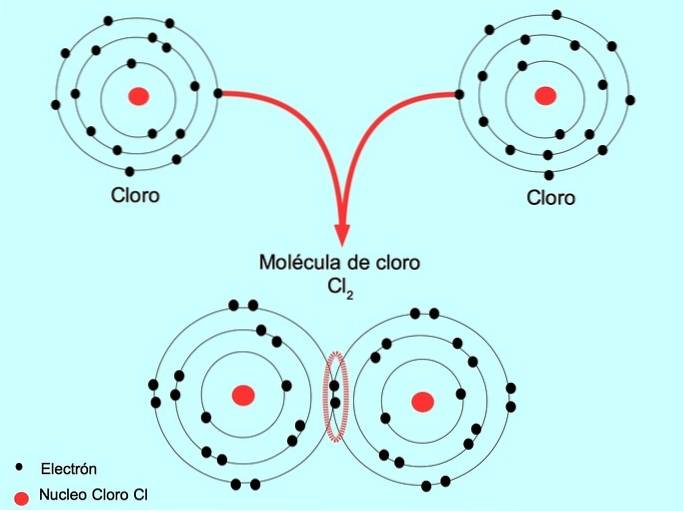
Doppelte kovalente Bindung
Die doppelte kovalente Bindung ist die Bindung, bei der vier Elektronen (zwei Paare) von Elektronen zwischen zwei Atomen geteilt werden. Zum Beispiel hat Sauerstoff 6 Elektronen in seiner letzten Hülle. Wenn zwei Sauerstoffatome kombiniert werden, werden vier Elektronen zwischen den beiden geteilt, wodurch jeweils 8 Elektronen in der letzten Hülle vorhanden sind..
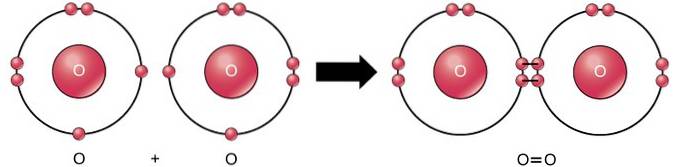
Dreifache kovalente Bindung
Die dreifache kovalente Bindung wird gebildet, wenn 6 Elektronen (oder drei Paare) zwischen zwei Atomen geteilt werden. Beispielsweise wird in dem Cyanwasserstoffmolekül HCN eine Dreifachbindung zwischen Kohlenstoff und Stickstoff gebildet, wie in der folgenden Abbildung gezeigt:
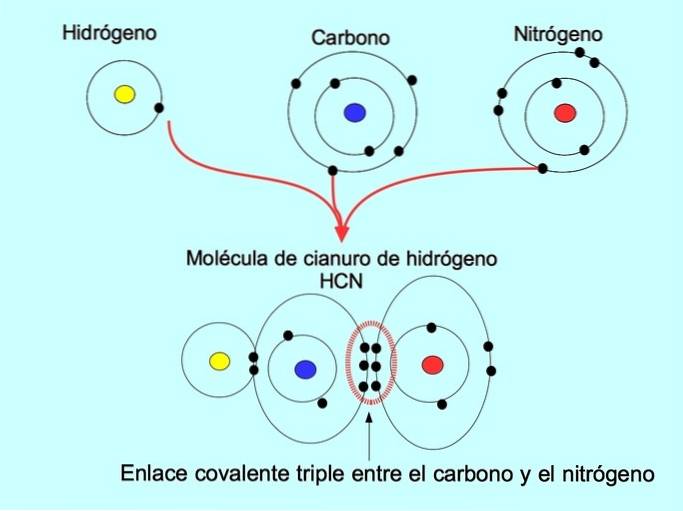
Koordinate oder Dativ kovalente Bindung
Die koordinierte oder dative kovalente Bindung ist die Bindung, die entsteht, wenn nur eines der Atome in der Bindung ein Elektronenpaar beisteuert. Zum Beispiel, wenn Ammoniak NH reagiert3 mit Bortrifluorid BF3, Stickstoff bindet sich mit zwei Elektronen direkt an Bor, das keine Elektronen zum Teilen zur Verfügung hat. Auf diese Weise bleiben sowohl Stickstoff als auch Bor mit 8 Elektronen in ihrer Valenzschale zurück..
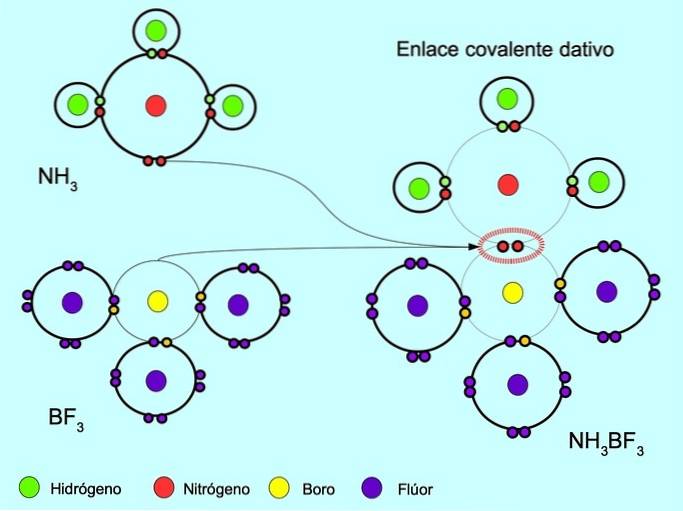
Siehe auch Organische und anorganische Verbindungen.
Intermolekulare Verbindungen
Moleküle verbinden sich durch Kräfte, die es ermöglichen, Substanzen in flüssigem oder festem Zustand zu bilden.
Dipol-Dipol-Bindungen oder Kräfte
Schwache intermolekulare Bindungen können zwischen polaren Molekülen hergestellt werden, wenn negative Pole von positiven Polen angezogen werden und umgekehrt. Zum Beispiel Methanal H.zweiC = O ist ein polares Molekül mit einer teilweise negativen Ladung auf Sauerstoff und einer teilweise positiven Ladung auf Wasserstoff. Die positive Seite eines Methanalmoleküls zieht die negative Seite eines anderen Methanalmoleküls an.
Wasserstoffbrücken oder -bindungen
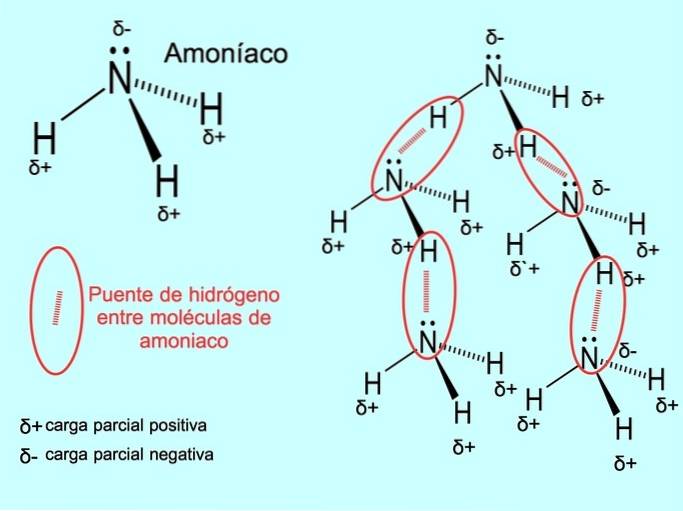
Die Wasserstoffbindung oder Wasserstoffbindung ist eine Bindung, die zwischen Molekülen hergestellt wird. Es tritt auf, wenn ein Wasserstoff im Molekül kovalent an einen Sauerstoff, einen Stickstoff oder ein Fluor gebunden ist. Sauerstoff, Stickstoff und Fluor sind Atome mit höherer Elektronegativität, daher ziehen sie Elektronen stärker an, wenn sie sie mit einem anderen weniger elektronegativen Atom teilen..
Zwischen den Wassermolekülen H bestehen WasserstoffbrückenzweiO- und NH-Ammoniak3 wie das Bild zeigt:
Sie könnten interessiert sein zu sehen:
- Atome und Moleküle.
- Beispiele für organische und anorganische Verbindungen.
Verweise
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemie. Neunte Ausgabe. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5. Auflage. Pearson Australia. Melbourne.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.