
Ethylethereigenschaften, Struktur, Herstellung, Verwendung
Das Ethylether, auch als Diethylether bekannt, ist es eine organische Verbindung, deren chemische Formel C ist4H.10O. Es zeichnet sich dadurch aus, dass es eine farblose und flüchtige Flüssigkeit ist. Daher sollten die Flaschen so dicht wie möglich verschlossen bleiben.
Dieser Ether wird als Mitglied der Dialkylether klassifiziert; das heißt, sie haben die Formel ROR ', wobei R und R' unterschiedliche Kohlenstoffsegmente darstellen. Und wie der zweite Name, Diethylether, beschreibt, binden zwei Ethylradikale an das Sauerstoffatom.

Ethylether wurde ursprünglich als Vollnarkose verwendet und 1846 von William Thomas Green Morton eingeführt. Aufgrund seiner Entflammbarkeit wurde seine Verwendung jedoch verworfen und durch andere weniger gefährliche Anästhetika ersetzt..
Diese Verbindung wurde auch verwendet, um die Zeit der Durchblutung während der Bewertung des kardiovaskulären Status von Patienten abzuschätzen..
Im Körper kann Diethylether in Kohlendioxid und Metaboliten umgewandelt werden. Letztere werden im Urin ausgeschieden. Der größte Teil des verabreichten Ethers wird jedoch ohne Modifikation in die Lunge ausgeatmet..
Andererseits wird es als Lösungsmittel für Seifen, Öle, Parfums, Alkaloide und Gummis verwendet..
Artikelverzeichnis
- 1 Struktur von Ethylether
- 1.1 Intermolekulare Kräfte
- 2 Physikalische und chemische Eigenschaften
- 2.1 Andere Namen
- 2.2 Summenformel
- 2.3 Molekulargewicht
- 2.4 Aussehen
- 2.5 Geruch
- 2.6 Geschmack
- 2.7 Siedepunkt
- 2.8 Schmelzpunkt
- 2.9 Flammpunkt
- 2.10 Löslichkeit in Wasser
- 2.11 Löslichkeit in anderen Flüssigkeiten
- 2.12 Dichte
- 2.13 Dampfdichte
- 2.14 Dampfdruck
- 2.15 Stabilität
- 2.16 Selbstentzündung
- 2.17 Zersetzung
- 2.18 Viskosität
- 2.19 Verbrennungswärme
- 2.20 Verdampfungswärme
- 2.21 Oberflächenspannung
- 2.22 Ionisationspotential
- 2.23 Geruchsschwelle
- 2.24 Brechungsindex
- 3 Erhalten
- 3.1 Aus Ethylalkohol
- 3.2 Aus Ethylen
- 4 Toxizität
- 5 Verwendungen
- 5.1 Organisches Lösungsmittel
- 5.2 Vollnarkose
- 5.3 Geist des Äthers
- 5.4 Beurteilung der Durchblutung
- 5.5 Lehrlabors
- 6 Referenzen
Struktur von Ethylether
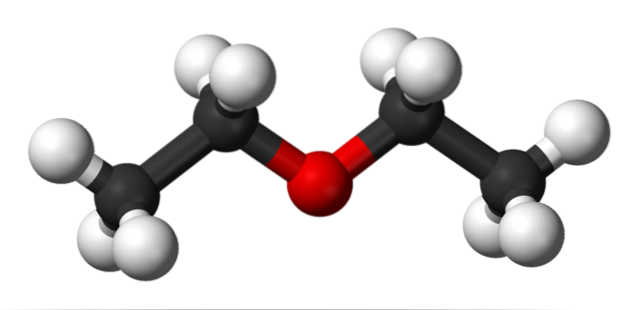
Im oberen Bild ist eine Darstellung mit einem Modell von Kugeln und Balken der Molekülstruktur von Ethylether dargestellt..
Wie zu sehen ist, weist die rote Kugel, die dem Sauerstoffatom entspricht, zwei Ethylgruppen auf, die auf beiden Seiten verbunden sind. Alle Verbindungen sind einfach, flexibel und drehen sich frei um die σ-Achsen.
Diese Rotationen führen zu Stereoisomeren, die als Konformere bekannt sind; dass sie mehr als Isomere alternative räumliche Zustände sind. Die Struktur des Bildes entspricht genau dem Antikonformer, in dem alle seine Atomgruppen versetzt (voneinander getrennt) sind..
Was wäre der andere Konformer? Das verfinsterte, und obwohl sein Bild nicht verfügbar ist, reicht es aus, es in einer U-Form zu visualisieren. An den oberen Enden des U befinden sich die Methylgruppen -CH3, die sterische Abstoßungen erfahren würden (im Raum kollidieren).
Daher wird erwartet, dass das CH-Molekül3CHzweiOCHzweiCH3 nehmen die meiste Zeit Anti-Shaping an.
Intermolekularen Kräfte
Durch welche intermolekularen Kräfte werden die Ethylethermoleküle in der flüssigen Phase gesteuert? Sie werden hauptsächlich dank der Dispersionskräfte in der Flüssigkeit gehalten, da ihrem Dipolmoment (1,5D) ein ausreichend mangelhafter Bereich der Elektronendichte (δ +) fehlt.
Dies liegt daran, dass kein Kohlenstoffatom in den Ethylgruppen zu viel Elektronendichte an das Sauerstoffatom abgibt. Das Vorgenannte ist anhand der vorliegenden elektrostatischen Potentialkarte von Ethylether ersichtlich (unteres Bild). Beachten Sie das Fehlen eines blauen Bereichs.
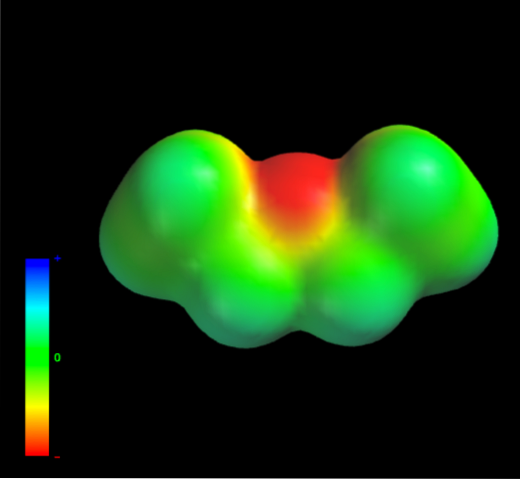
Auch hier kann Sauerstoff keine Wasserstoffbrückenbindungen bilden, da in der Molekülstruktur keine O-H-Bindungen vorhanden sind. Daher sind es die augenblicklichen Dipole und ihre Molekülmasse, die ihre Dispersionskräfte begünstigen..
Trotzdem ist es in Wasser gut löslich. Warum? Weil sein Sauerstoffatom mit einer höheren Elektronendichte Wasserstoffbrückenbindungen von einem Wassermolekül aufnehmen kann:
(CH3CHzwei)zweiODERδ- - δ+H-OH
Diese Wechselwirkungen sind dafür verantwortlich, dass sich 6,04 g dieses Ethers in 100 ml Wasser lösen.
Physikalische und chemische Eigenschaften
Andere Namen
-Diethylether
-Ethoxyethan
-Ethyloxid
Molekularformel
C.4H.10O oder (C.zweiH.5)zweiODER.
Molekulargewicht
74,14 g / mol.
Aussehen
Farblose Flüssigkeit.
Geruch
Süß und würzig.
Geschmack
Brennend und süß.
Siedepunkt
34,6 ºC (94,3 ºF) bei 760 mmHg.
Schmelzpunkt
--116,3 ° C (177,3 ° F). Stabile Kristalle.
Zündpunkt
-49ºF (geschlossener Behälter).
Wasserlöslichkeit
6,04 g / 100 ml bei 25 ° C..
Löslichkeit in anderen Flüssigkeiten
Mischbar mit kurzkettigen aliphatischen Alkoholen, Benzol, Chloroform, Petrolether, Fettlösungsmittel, vielen Ölen und konzentrierter Salzsäure.
Löslich in Aceton und sehr gut löslich in Ethanol. Es ist auch in Naphtha, Benzol und Ölen löslich.
Dichte
0,714 mg / ml bei 20 ° C.
Wasserdampfdichte
2,55 (bezogen auf Luft mit Dichte 1).
Dampfdruck
442 mmHg bei 68ºF. 538 mmHg bei 25 ° C. 58,6 kPa bei 20 ºC.
Stabilität
Es wird langsam durch Einwirkung von Luft, Feuchtigkeit und Licht unter Bildung von Peroxiden oxidiert.
Die Bildung von Peroxiden kann in geöffneten Ätherbehältern auftreten, die länger als sechs Monate gelagert werden. Peroxide können durch Reibung, Aufprall oder Erwärmung zur Detonation gebracht werden.
Vermeiden Sie den Kontakt mit: Zink, Halogenen, nichtmetallischen Oxyhalogeniden, starken Oxidationsmitteln, Chromylchlorid, Tementinölen, Metallnitraten und Chloriden.
Selbstentzündung
180 ºC (356 ºF).
Zersetzung
Beim Erhitzen zersetzt es sich und stößt scharfen und reizenden Rauch aus.
Viskosität
0,2448 cPoise bei 20 ºC.
Verbrennungswärme
8,807 kcal / g.
Verdampfungswärme
89,8 cal / g bei 30 ºC.
Oberflächenspannung
17,06 Dyn / cm bei 20 ° C..
Ionisationspotential
9,53 eV.
Geruchsschwelle
0,83 ppm (Reinheit nicht angegeben).
Brechungsindex
1.355 bei 15 ºC.
Erhalten
Aus Ethylalkohol
Ethylether kann aus Ethylalkohol in Gegenwart von Schwefelsäure als Katalysator erhalten werden. Schwefelsäure in einem wässrigen Medium dissoziiert unter Bildung des Hydroniumions H.3ODER+.
Der wasserfreie Ethylalkohol fließt durch die Schwefelsäurelösung, die zwischen 130 ° C und 140 ° C erhitzt wird, und erzeugt die Protonierung von Ethylalkoholmolekülen. Anschließend reagiert ein anderes nicht protoniertes Ethylalkoholmolekül mit dem protonierten Molekül.
Wenn dies geschieht, fördert der nukleophile Angriff des zweiten Ethylalkoholmoleküls die Freisetzung von Wasser aus dem ersten Molekül (dem protonierten); als Ergebnis wurde ein protonierter Ethylether (CH3CHzweiOHCHzweiCH3) mit teilweise positiv geladenem Sauerstoff.
Dieses Syntheseverfahren verliert jedoch an Effizienz, da die Schwefelsäure allmählich mit dem dabei erzeugten Wasser (Produkt der Dehydratisierung von Ethylalkohol) verdünnt wird..
Die Reaktionstemperatur ist kritisch. Bei Temperaturen unter 130 ° C ist die Reaktion langsam und Ethylalkohol wird größtenteils destilliert..
Oberhalb von 150 ºC bewirkt Schwefelsäure die Bildung von Ethylen (dem Doppelbindungsalken), anstatt sich mit Ethylalkohol zu Ethylether zu verbinden.
Aus Ethylen
In dem umgekehrten Verfahren, dh der Hydratisierung von Ethylen in der Dampfphase, kann neben Ethylalkohol auch Ethylether als Nebenprodukt gebildet werden. Tatsächlich produziert dieser Syntheseweg den größten Teil dieser organischen Verbindung..
Bei diesem Verfahren werden Phosphorsäurekatalysatoren verwendet, die an einen festen Träger gebunden sind und eingestellt werden können, um mehr Ether zu erzeugen..
Die Dampfphasen-Dehydratisierung von Ethanol in Gegenwart von Aluminiumoxidkatalysatoren kann eine Ausbeute von 95% bei der Herstellung von Ethylether ergeben..
Toxizität
Kann durch Kontakt Haut- und Augenreizungen verursachen. Kontakt mit der Haut kann zu Austrocknung und Rissen führen. Äther dringt normalerweise nicht in die Haut ein, da er schnell verdunstet.
Durch Äther verursachte Augenreizungen sind normalerweise mild, und bei starken Reizungen ist der Schaden im Allgemeinen reversibel.
Seine Einnahme erzeugt narkotische Wirkungen und Magenreizungen. Schwere Einnahme kann Nierenschäden verursachen.
Das Einatmen von Äther kann zu Reizungen der Nase und des Rachens führen. Bei einer Inhalation von Äther kann Folgendes auftreten: Schläfrigkeit, Erregung, Schwindel, Erbrechen, unregelmäßige Atmung und erhöhter Speichelfluss..
Hohe Exposition kann zu Bewusstlosigkeit und sogar zum Tod führen.
OSHA legt eine berufliche Expositionsgrenze in der Luft von 800 ppm fest, gemittelt über eine 8-stündige Schicht..
Augenreizung: 100 ppm (Mensch). Augenreizung: 1200 mg / m3 (400 ppm).
Anwendungen
Organische Lösung
Es ist ein organisches Lösungsmittel, das zum Auflösen von Brom, Jod und anderen Halogenen verwendet wird. die meisten Lipide (Fette), Harze, reine Kautschuke, einige Alkaloide, Gummis, Parfums, Celluloseacetat, Cellulosenitrat, Kohlenwasserstoffe und Farbstoffe.
Darüber hinaus wird es zur Extraktion von Wirkstoffen aus tierischen und pflanzlichen Geweben verwendet, da es eine geringere Dichte als Wasser hat und darauf schwimmt und die gewünschten Substanzen im Äther gelöst bleiben..
Vollnarkose
Es wird seit 1840 als Vollnarkose eingesetzt und ersetzt Chloroform, da es einen therapeutischen Vorteil hat. Es ist jedoch eine brennbare Substanz und stößt daher bei der Verwendung im klinischen Umfeld auf schwerwiegende Schwierigkeiten..
Darüber hinaus führt es bei Patienten zu unerwünschten postoperativen Nebenwirkungen wie Übelkeit und Erbrechen..
Aus diesen Gründen wurde die Verwendung von Ether als Vollnarkotikum verworfen und durch andere Anästhetika wie Halothan ersetzt..
Äthergeist
Mit Ethanol vermischter Ether wurde verwendet, um die als Äthergeist bezeichnete Lösung zu bilden, die bei der Behandlung von Magenblähungen und milderen Formen von Gastralgie verwendet wurde..
Bewertung der Durchblutung
Äther wurde verwendet, um die Durchblutung zwischen einem Arm und der Lunge zu bewerten. Äther wird in einen Arm injiziert und bringt das Blut zum rechten Vorhof, dann zum rechten Ventrikel und von dort zur Lunge..
Die Zeit, die von der Injektion des Äthers bis zur Erfassung des Geruchs des Äthers in der ausgeatmeten Luft vergeht, beträgt ungefähr 4 bis 6 s.
Lehrlabors
Äther wird in Lehrlabors in vielen Experimenten verwendet; zum Beispiel bei der Demonstration von Mendels Gesetzen der Genetik.
Äther wird verwendet, um die Fliegen der Gattung Drosophila zu wiegen und die notwendigen Kreuzungen zwischen ihnen zuzulassen, wodurch die Gesetze der Genetik bewiesen werden
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Der Sevier. (2018). Diethylether. Science Direct. Wiederhergestellt von: sciencedirect.com
- Die Herausgeber der Encyclopaedia Britannica. (2018). Ethylether. ncyclopædia Britannica. Wiederhergestellt von: britannica.com
- PubChem (2018). Äther. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Diethylether. Wiederhergestellt von: en.wikipedia.org
- Sicherheitsblatt XI: Ethylether. [PDF]. Wiederhergestellt von: quimica.unam.mx



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.