
Struktur, Eigenschaften und Verwendung von Silbersulfid (Ag2S)
Das Silbersulfid ist eine anorganische Verbindung, deren chemische Formel Ag istzweiS. Es besteht aus einem grau-schwarzen Feststoff, der durch Kationen Ag gebildet wird+ und S Anionenzwei- im Verhältnis 2: 1. Die S.zwei- ist sehr ähnlich zu Ag+, denn beide sind weiche Ionen und schaffen es, sich miteinander zu stabilisieren.
Silberornamente neigen dazu, sich zu verdunkeln und ihren charakteristischen Glanz zu verlieren. Die Farbänderung ist kein Produkt der Oxidation von Silber, sondern seiner Reaktion mit Schwefelwasserstoff, der in geringen Konzentrationen in der Umwelt vorhanden ist; Dies kann durch Verrottung oder Abbau von Pflanzen, Tieren oder schwefelreichen Lebensmitteln verursacht werden.

Die H.zweiS, dessen Molekül ein Schwefelatom trägt, reagiert mit Silber gemäß der folgenden chemischen Gleichung: 2Ag (s) + H.zweiS (g) => AgzweiS (s) + H.zwei(G)
Daher ist die AgzweiS ist verantwortlich für die auf Silber gebildeten schwarzen Schichten. In der Natur kommt dieses Sulfid jedoch auch in den Mineralien Acantite und Argentite vor. Die beiden Mineralien unterscheiden sich von vielen anderen durch ihre glänzenden schwarzen Kristalle, wie die im Festkörper im obigen Bild..
Die AGzweiS hat polymorphe Strukturen, attraktive elektronische und optoelektronische Eigenschaften, ist ein Halbleiter und verspricht, ein Material für die Herstellung von Photovoltaik-Geräten wie Solarzellen zu sein..
Artikelverzeichnis
- 1 Struktur
- 2 Eigenschaften
- 2.1 Molekulargewicht
- 2.2 Aussehen
- 2.3 Geruch
- 2.4 Schmelzpunkt
- 2.5 Löslichkeit
- 2.6 Struktur
- 2.7 Brechungsindex
- 2.8 Dielektrizitätskonstante
- 2.9 Elektronik
- 2.10 Reduktionsreaktion
- 3 Nomenklatur
- 3.1 Systematik
- 3.2 Lager
- 3.3 Traditionell
- 4 Verwendungen
- 5 Referenzen
Struktur
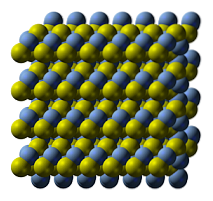
Das obere Bild zeigt die Kristallstruktur von Silbersulfid. Die blauen Kugeln entsprechen den Ag-Kationen+, während die gelben zu den S-Anionenzwei-. Die AGzweiS ist polymorph, was bedeutet, dass es unter bestimmten Temperaturbedingungen verschiedene Kristallsysteme annehmen kann..
Wie? Durch einen Phasenübergang. Die Ionen werden so umgeordnet, dass der Temperaturanstieg und die Schwingungen des Feststoffs das Gleichgewicht zwischen elektrostatischer Anziehung und Abstoßung nicht stören. Wenn dies geschieht, wird gesagt, dass es einen Phasenübergang gibt und der Feststoff daher neue physikalische Eigenschaften (wie Glanz und Farbe) aufweist..
Die AGzweiS hat bei normalen Temperaturen (unter 179 ° C) eine monokline Kristallstruktur (α-AgzweiS). Zusätzlich zu dieser festen Phase gibt es zwei weitere: den bcc (kubisch zentriert auf dem Körper) zwischen 179 und 586 ° C und den fcc (kubisch zentriert auf den Flächen) bei sehr hohen Temperaturen (δ-AgzweiS).
Das Mineral Argentit besteht aus der fcc-Phase, auch als β-Ag bekanntzweiS. Sobald es abgekühlt und in Akanthit umgewandelt ist, überwiegen seine strukturellen Merkmale zusammen. Daher existieren beide kristallinen Strukturen nebeneinander: die monokline und die bcc. Daher entstehen schwarze Feststoffe mit hellen und interessanten Obertönen..
Eigenschaften
Molekulargewicht
247,80 g / mol
Aussehen
Grauschwarze Kristalle
Geruch
Toilette.
Schmelzpunkt
836 ° C. Dieser Wert stimmt mit der Tatsache überein, dass AgzweiS ist eine Verbindung mit wenig ionischem Charakter und schmilzt daher bei Temperaturen unter 1000 ° C..
Löslichkeit
In Wasser nur 6,21 ∙ 10-fünfzehn g / l bei 25 ° C. Das heißt, die Menge des schwarzen Feststoffs, der solubilisiert wird, ist vernachlässigbar. Dies ist wiederum auf den niedrigen polaren Charakter der Ag-S-Bindung zurückzuführen, bei der es keinen signifikanten Unterschied in der Elektronegativität zwischen den beiden Atomen gibt..
Auch die AgzweiS ist in allen Lösungsmitteln unlöslich. Kein Molekül kann seine kristallinen Schichten effizient in Ag-Ionen trennen+ und S.zwei- solvatisiert.
Struktur
Im Bild der Struktur sehen Sie auch vier Schichten von S-Ag-S-Bindungen, die sich übereinander bewegen, wenn der Feststoff einer Kompression ausgesetzt wird. Dieses Verhalten bedeutet, dass es, obwohl es ein Halbleiter ist, wie viele Metalle bei Raumtemperatur duktil ist..
S-Ag-S-Schichten passen aufgrund ihrer Winkelgeometrien, die als Zickzack betrachtet werden, richtig. Da es eine Kompressionskraft gibt, bewegen sie sich auf einer Verschiebungsachse und verursachen so neue nichtkovalente Wechselwirkungen zwischen Silber- und Schwefelatomen..
Brechungsindex
2.2
Dielektrizitätskonstante
6
Elektronisch
Die AGzweiS ist ein amphoterer Halbleiter, das heißt, er verhält sich so, als wäre er vom Typ n und vom Typ p. Darüber hinaus ist es nicht spröde, weshalb es für seine Anwendung in elektronischen Geräten untersucht wurde..
Reduktionsreaktion
Die AGzweiS kann durch Baden der schwarzen Stücke mit heißem Wasser, NaOH, Aluminium und Salz zu metallischem Silber reduziert werden. Folgende Reaktion findet statt:
3AgzweiS (s) + 2Al (s) + 3HzweiO (l) => 6Ag (s) + 3HzweiS (ac) + AlzweiODER3(s)
Nomenklatur
Silber, dessen Elektronenkonfiguration [Kr] 4d ist105s1, es kann nur ein Elektron verlieren: sein äußerstes Orbital 5s. Somit ist das Kation Ag+ bleibt mit einer Elektronenkonfiguration [Kr] 4d übrig10. Daher hat es eine eindeutige Wertigkeit von +1, die bestimmt, wie seine Verbindungen genannt werden sollen..
Schwefel hat andererseits eine elektronische Konfiguration [Ne] 3szwei3p4, und es braucht zwei Elektronen, um sein Valenzoktett zu vervollständigen. Wenn es diese beiden Elektronen (aus Silber) gewinnt, wandelt es sich in das Sulfidanion S umzwei-, mit [Ar] Einstellung. Das heißt, es ist isoelektronisch für das Edelgas Argon.
Also die AgzweiS muss nach folgenden Nomenklaturen aufgerufen werden:
Systematisch
AffeSulfid von gegebenSilber. Hier wird die Anzahl der Atome jedes Elements berücksichtigt und sie werden mit den Präfixen der griechischen Zähler markiert.
Lager
Silbersulfid. Da es eine eindeutige Wertigkeit von +1 hat, wird es nicht mit römischen Ziffern in Klammern angegeben: Silber (I) sulfid; was falsch ist.
Traditionell
Silbersulfidico. Da Silber mit einer Wertigkeit von +1 "funktioniert", wird das Suffix -ico zu seinem Namen hinzugefügt. argentum In Latein.
Anwendungen
Einige der neuartigen Verwendungen für AgzweiS sind wie folgt:
-Die kolloidalen Lösungen seiner Nanopartikel (mit unterschiedlichen Größen) haben eine antibakterielle Aktivität, sind nicht toxisch und können daher in den Bereichen Medizin und Biologie verwendet werden..
-Seine Nanopartikel können sogenannte Quantenpunkte bilden. Sie absorbieren und emittieren Strahlung mit größerer Intensität als viele fluoreszierende organische Moleküle, so dass sie diese als biologische Marker ersetzen können.
-Die Strukturen von α-AgzweiS bewirken, dass es bemerkenswerte elektronische Eigenschaften aufweist, die als Solarzellen verwendet werden können. Ebenso ist es ein Ausgangspunkt für die Synthese neuer thermoelektrischer Materialien und Sensoren..
Verweise
- Mark Peplow. (17. April 2018). Halbleitersilbersulfid erstreckt sich wie Metall. Entnommen aus: cen.acs.org
- Zusammenarbeit: Autoren und Herausgeber der Bände III / 17E-17F-41C () Silbersulfid (Ag2S) -Kristallstruktur. In: Madelung O., Rössler U., Schulz M. (Hrsg.) Nicht-tetraedrisch gebundene Elemente und binäre Verbindungen I. Landolt-Börnstein - Gruppe III Kondensierte Materie (Numerische Daten und funktionale Beziehungen in Wissenschaft und Technologie), Band 41C. Springer, Berlin, Heidelberg.
- Wikipedia. (2018). Silbersulfid. Entnommen aus: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (Juli 2016). AgzweiS Silbersulfid-Nanopartikel und kolloidale Lösungen: Synthese und Eigenschaften. Entnommen aus: sciencedirect.com
- Azo-Materialien. (2018). Silbersulfid (AgzweiS) Halbleiter. Entnommen aus: azom.com
- A. Nwofe. (2015). Perspektiven und Herausforderungen von Silbersulfid-Dünnfilmen: Ein Überblick. Abteilung für Materialwissenschaft und erneuerbare Energien, Abteilung für Arbeitsphysik, Ebonyi State University, Abakaliki, Nigeria.
- UMassAmherst. (2011). Vorlesungsvorführungen: Reinigung von angelaufenem Silber. Entnommen aus: lecturedemos.chem.umass.edu
- Studie. (2018). Was ist Silbersulfid? - Chemische Formel & Verwendung. Entnommen aus: study.com

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.