
Struktur, Eigenschaften, Verwendung, Synthese von Kaliumsulfat (K2SO4)

Das Kaliumsulfat ist ein weißes oder farbloses anorganisches Salz, dessen chemische Formel K istzweiSW4. Es war bereits im 14. Jahrhundert bekannt und wurde im 17. Jahrhundert als Salt Duplicatum bezeichnet, da es eine Kombination aus einem sauren Salz und einem alkalischen Salz ist..
Kaliumsulfat kommt in Arcanit in mineralischer Form vor, seine Präsentation ist jedoch häufiger in den sogenannten Stassfurter Salzen. Dies sind Co-Kristallisationen von Kalium-, Magnesium-, Calcium- und Natriumsulfaten, die in Mineralien wie Leonit und Polyhalogenit beobachtet werden können..

Kaliumsulfat ist ein wenig toxisches Salz und verursacht nur bei Kontakt mit den Augen, den Atemwegen oder dem Verdauungstrakt Reizungen. Es gibt keine Hinweise auf eine krebserzeugende oder mutagene Wirkung.
Kaliumsulfat wird als Dünger verwendet, insbesondere in Kulturen, die anfällig für Chloride sind. Dies ist der Fall bei Tabak und Kartoffeln. Die Verbindung liefert Kalium, einen der drei Hauptnährstoffe in Pflanzen, und Schwefel, der in ihren Proteinen vorhanden ist..
Artikelverzeichnis
- 1 Struktur
- 1.1 Kristalline Phasen
- 1.2 Ionengewirr
- 2 Physikalische und chemische Eigenschaften
- 2.1 Namen
- 2,2 Molmasse
- 2.3 Aussehen
- 2.4 Dichte
- 2.5 Schmelzpunkt
- 2.6 Siedepunkt
- 2.7 Löslichkeit in Wasser
- 2.8 Löslichkeit in organischen Lösungsmitteln
- 2.9 Brechungsindex (nD)
- 2.10 Reaktivität
- 3 Synthese
- 3.1 Erste Methode
- 3.2 Zweite Methode
- 3.3 Dritte Methode
- 3.4 Vierte Methode
- 4 Verwendungen
- 4.1 Dünger
- 4.2 Industrielle Verwendung und als Rohstoff
- 4.3 Medizin
- 4.4 Veterinärmedizin
- 4.5 Lebensmittelaroma
- 4.6 Andere Verwendungen
- 5 Risiken
- 6 Referenzen
Struktur
Kristalline Phasen
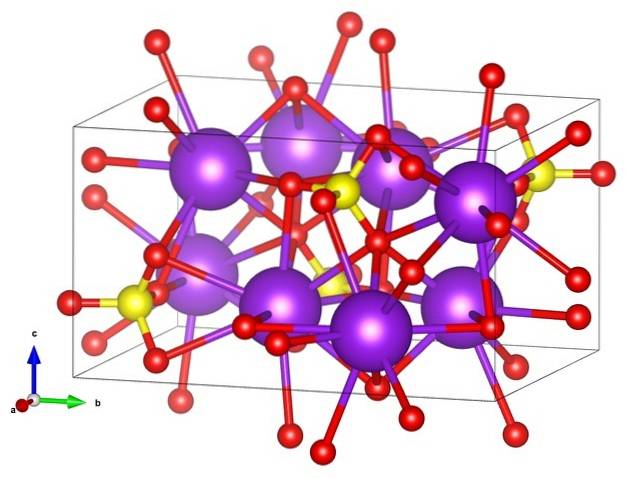
Im ersten Bild wurde die Strukturformel von Kaliumsulfat gezeigt. Für jedes SO-Anion4zwei-, der tetraedrischen Geometrie gibt es zwei Kationen K.+, die durch lila Kugeln dargestellt werden kann (oberes Bild).
Somit haben wir oben die orthorhombische Kristallstruktur von K.zweiSW4, mit SO Anionen4zwei- dargestellt durch gelbe und rote Kugeln; während die K-Kationen+, bereits gesagt, es sind die lila Kugeln (etwas robuster).
Diese Darstellung kann Verwirrung stiften, wenn Sie der Meinung sind, dass die Balken tatsächlich Koordinationsverknüpfungen entsprechen. Sie zeigen vielmehr an, welches Ion direkt oder eng mit einem anderen um es herum interagiert. Deshalb "verbindet" sich jeder Sauerstoff mit fünf K.+ (ODER3SWzwei-- K.+) und diese wiederum mit zehn Sauerstoffatomen aus anderen umgebenden Sulfatanionen.
Es gibt dann eine etwas "seltene" Koordinationssphäre für Kalium in K.zweiSW4::
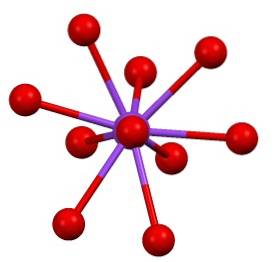
Diese kristalline Struktur entspricht dem polymorphen β-KzweiSW4. Beim Erhitzen auf 583 ºC tritt ein Übergang in die α-K-Phase aufzweiSW4, das ist sechseckig.
Ionengewirr
Sicherlich die Struktur von K.zweiSW4 Für ein anorganisches Salz ist es ungewöhnlich kompliziert. Seine Ionen sind so positioniert, dass sie eine Art bedeutungsloses Gewirr bilden und für das bloße Auge keine Periodizität aufweisen.
Diejenigen, die sich der Kristallographie widmen, können sich diesem Gewirr angemessener und beschreibender nähern und es von den drei räumlichen Achsen aus beobachten.
Beachten Sie, dass seine verworrene Struktur erklären könnte, warum der K.zweiSW4 bildet keine Hydrate: H-MolekülezweiOder sie haben keine Möglichkeit, das Kristallgitter zu durchdringen, um Kaliumkationen zu hydratisieren.
Auch bei so vielen Wechselwirkungen, die im Ionengewirr enthalten sind, ist zu erwarten, dass dieses Kristallgitter eine gewisse Stabilität gegen Hitze aufweist; und tatsächlich ist dies der Fall, da der Schmelzpunkt von K.zweiSW4 beträgt 1.069 ºC, was zeigt, dass seine Ionen stark kohäsiv sind.
Physikalische und chemische Eigenschaften

Namen
-Kaliumsulfat
-Kalisulfat
-Arkanit
-Schwefelkali
Molmasse
174,259 g / mol
Aussehen
Weißer, geruchloser, bitter schmeckender Kristallfeststoff, Granulat oder Pulver.
Dichte
2,66 g / cm3
Schmelzpunkt
1.069 ºC
Siedepunkt
1.689 ºC
Wasserlöslichkeit
111 g / l bei 20 ºC
120 g / l bei 25 ºC
240 g / l bei 100 ºC
Die Löslichkeit in Wasser nimmt aufgrund der Anwesenheit von Kaliumchlorid, KCl oder Ammoniumsulfat (NH) ab4)zweiSW4, aufgrund des gemeinsamen Ioneneffekts.
Löslichkeit in organischen Lösungsmitteln
In Glycerin schwer löslich, in Aceton und Schwefelkohlenstoff jedoch unlöslich.
Brechungsindex (nD)
1.495
Reaktivität
Kaliumsulfat kann mit Schwefelsäure reagieren und unter Bildung von Kaliumbisulfat (KHSO) ansäuern4). Es kann bei hohen Temperaturen zu Kaliumsulfid (K) reduziert werdenzweiS).
Synthese
Erste Methode
Kaliumsulfat wird durch Umsetzung von Kaliumchlorid mit Schwefelsäure synthetisiert. Die Synthese von Kaliumsulfat erfolgt in zwei Schritten. Der erste Schritt beinhaltet die Bildung von Kaliumbisulfat.
Dies ist eine exotherme Reaktion, da sie Wärme abgibt und daher keine externe Wärmeversorgung erfordert. Die Reaktion wird bei Raumtemperatur durchgeführt.
KCl + H.zweiSW4 => HCl + KHSO4
Der zweite Schritt der Reaktion ist endotherm, dh es erfordert die Zufuhr von Wärme, damit sie auftreten kann.
KCl + KHSO4 => HCl + K.zweiSW4
Zweite Methode
Kaliumsulfat kann durch Neutralisationsreaktion von Schwefelsäure mit einer Base, Kaliumhydroxid, synthetisiert werden:
H.zweiSW4 + 2 KOH => K.zweiSW4 + 2 hzweiODER
Dritte Methode
Kaliumsulfat entsteht durch die Reaktion von Schwefeldioxid, Sauerstoff, Kaliumchlorid und Wasser.
Vierte Methode
Kaliumsulfat wird durch Extraktion des in einer Salzlösung vorhandenen Kaliumsulfats aus dem Loop Nur-Becken in China hergestellt. Kaliumsulfat wird durch Zugabe der Säuerungsverbindung Natriumtripolyphosphat / Harnstoffphosphat von den unlöslichen Bestandteilen der Salzlösung getrennt.
Diese Verbindung erhöht den Unterschied zwischen der Löslichkeit von Kaliumsulfat und der Löslichkeit der anderen weniger löslichen Verbindungen und erreicht nach Angaben der Hersteller des Verfahrens ein 100% reines Kaliumsulfat. Im engeren Sinne handelt es sich nicht um eine Synthesemethode, sondern um eine neuartige Extraktionsmethode.
Anwendungen
Dünger

Die Verwendung von Kaliumsulfat als Dünger ist seine Hauptanwendung. 90% der Gesamtproduktion werden für diesen Zweck verwendet. Seine Verwendung ist der von Kaliumchlorid in solchen Kulturen vorzuziehen, die gegenüber dem Vorhandensein von Chlorid im Boden empfindlich sind; zum Beispiel Tabak.
Kaliumsulfat hat einen Kaliumgehalt von 40-44%, während seine Schwefelkonzentration 17-18% der Verbindung ausmacht. Kalium ist notwendig, um viele wesentliche Funktionen für Pflanzen zu erfüllen, da es enzymatische Reaktionen, Proteinsynthese, Stärkebildung usw. aktiviert..
Darüber hinaus ist Kalium an der Regulierung des Wasserflusses in den Blättern beteiligt. Schwefel ist für die Proteinsynthese notwendig, da es in Aminosäuren vorhanden ist, die es besitzen; Dies ist der Fall bei Methionin, Cystein und Cystin und greift auch in enzymatische Reaktionen ein.
Sogar Kaliumsulfat wird verwendet, indem auf die Blätter Kaliumsulfatpartikel gesprüht werden, die kleiner als 0,015 mm sind.
Industrielle Verwendung und als Rohstoff
Rohes Kaliumsulfat wird bei der Herstellung von Glas und bei der Herstellung von Alaun und Kaliumcarbonat verwendet. Es wird als Reagenz bei der Herstellung von Kosmetika verwendet. Es wird bei der Herstellung von Bier als Wasserkorrekturmittel verwendet.
Medizin
Es wird verwendet, um eine starke Abnahme der Plasma-Kaliumkonzentration (Hypokaliämie) zu korrigieren, die durch übermäßigen Einsatz von Diuretika verursacht wird, die die Kaliumausscheidung im Urin erhöhen..
Kalium ist das intrazelluläre Hauption anregbarer Zellen, einschließlich Herzzellen. Daher beeinträchtigt eine starke Abnahme des Kaliums im Plasma die Herzfunktion und muss sofort korrigiert werden..
Kaliumsulfat hat eine kathartische Wirkung, das heißt, es begünstigt das Ausstoßen des Stuhls aus dem Dickdarm. Aus diesem Grund wird eine Mischung aus Kalium-, Magnesium- und Natriumsulfaten verwendet, um den Dickdarm vom Stuhl zu befreien, bevor eine Koloskopie durchgeführt wird, die eine bessere Visualisierung des Dickdarms durch den Arzt ermöglicht..
Tierarzt
Kaliumsulfat wurde verwendet, um den Methioninbedarf in Geflügelfutter zu senken. Das Vorhandensein von 0,1% Kaliumsulfat im Futter von Legehennen ist mit einer Steigerung der Eiproduktion um 5% verbunden.
Lebensmittelaroma
Es ist ein Aromastoff, der Lebensmitteln einen bitteren und salzigen Geschmack verleiht, der bei einigen von ihnen wünschenswert ist. Zusätzlich wird angemerkt, dass Kaliumsulfat mit den vier Grundaromen ausgestattet ist: Süße, Bitterkeit, Säure und Salzgehalt..
Salzgehalt, Säuregehalt und Bitterkeit nehmen mit der Konzentration von Kaliumsulfat zu, während die Süße abnimmt.
Andere Verwendungen
Kaliumsulfat wird als Pyrotechnik in Kombination mit Kaliumnitrat verwendet, um eine violette Flamme zu erzeugen. Wird als Blitzreduzierer bei Artillerie-Triebwerksladungen verwendet.
Darüber hinaus wird es als viskositätserhöhendes Mittel in kosmetischen Produkten wie Gesichtscremes eingesetzt..
Risiken
Kaliumsulfat ist eine wenig toxische Verbindung mit einer sehr geringen Letalität. Die LD50 für die orale Dosis bei Mäusen beträgt 6.600 mg / kg Tiergewicht, was darauf hinweist, dass eine hohe Dosis erforderlich ist, um den Tod der Maus zu verursachen. Der gleiche LD50-Wert tritt bei Ratten auf.
In den Augen kann Kaliumsulfat bei Kontakt mechanische Reizungen verursachen. Auf der Haut verursacht Kaliumsulfat nur geringe Schäden im industriellen Umgang..
Kaliumsulfat kann beim Verschlucken Magen-Darm-Reizungen mit Übelkeit, Erbrechen und Durchfall verursachen. Und schließlich führt das Einatmen von Kaliumsulfatstaub zu Reizungen der Atemwege..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Kaliumsulfat. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Kaliumsulfat. PubChem-Datenbank. CID = 24507. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5. Juli 2018). Kaliumsulfat. Royal Society of Chemistry. Wiederhergestellt von: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (neunzehnhundertsechsundneunzig). Themen der Phosphatchemie. World Scientific. Wiederhergestellt von: books.google.co.ve
- Chemisches Buch. (2017). Kaliumsulfat. Wiederhergestellt von: Chemicalbook.com
- Shoujiang L. et al. (2019). Reinigung und schnelle Auflösung von Kaliumsulfat in wässrigen Lösungen. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Kaliumsulfat. Wiederhergestellt von: drugbank.ca
- Die Mosaic Company. (2019). Kaliumsulfat. Pflanzenernährung. Wiederhergestellt von: cropnutrition.com
- Drogen. (2018). Natriumsulfat, Kaliumsulfat und Magnesiumsulfat (oral). Wiederhergestellt von: drugs.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.